TRANSFORMAÇÃO ISOTÉRMICA
Como a temperatura se mantém constante, não há variação de energia interna:
∆U = 0
Pela 1ª Lei da Termodinâmica, temos:
∆U = Q – W ⇒ Q – W = 0
W = Q
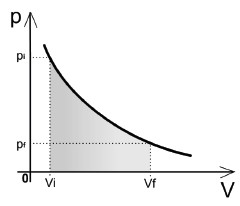
Assim, todo calor é convertido em trabalho:
- Se o gás receber calor (Q > 0), o gás sofre expansão (W > 0).
- Se o gás perder calor (Q < 0), o gás sofre compressão (W < 0).
Observação: Apenas para os curiosos! O cálculo do trabalho em uma transformação isotérmica envolve a resolução de uma integral e seu resultado final é:

Exercício Resolvido 1: Em um sistema fechado, um gás ideal passa lentamente de um estado inicial 1 para um estado final 2 devido a uma expansão isotérmica. Assim, ao final deste processo termodinâmico,
a) O gás não terá absorvido energia na forma de calor uma vez que a temperatura no estado 1 é igual à temperatura no estado 2.
b) O trabalho realizado pelo gás será igual à variação da energia interna calculada entre o estado 2 e o estado 1.
c) O calor absorvido pelo gás será igual à variação da energia interna calculada entre o estado 2 e o estado 1.
d) O trabalho realizado sobre o gás será igual a energia por ele absorvida na forma de calor ao passar do estado 1 para o estado 2.
e) O trabalho realizado pelo gás será igual à energia por ele absorvida na forma de calor ao passar do estado 1 para o estado 2.
Resolução: E
Pela Primeira Lei da Termodinâmica, se o processo foi isotérmico, não houve variação da energia interna do gás, assim todo o calor recebido pelo gás foi transformado para reavaliar o trabalho de expansão.
TRA NSFORMAÇÃO ISOVOLUMÉTRICA
Como o volume se mantém constante, não há realização de trabalho: W = 0
Pela 1ª Lei da Termodinâmica, temos:
∆U = Q – W = Q – 0
∆U = Q
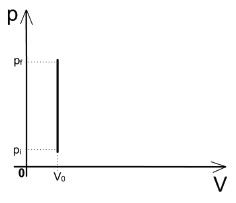
Assim, todo calor é convertido em energia interna:
- Se o gás receber calor (Q > 0), há aumento da temperatura do gás (∆U > 0).
- Se o gás perder calor (Q < 0), há redução da temperatura do gás (∆U < 0).
TRANSFORMAÇÃO ISOBÁRICA
Com a pressão constante, podemos calcular diretamente o trabalho do gás e em seguida usar a equação de Clapeyron:
W = P⋅∆V = nR⋅∆T
Pela 1ª Lei da Termodinâmica, temos:
∆U = Q – W
Q = ∆U + W
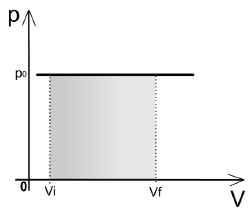
- Se o gás receber calor (Q > 0), parte dessa energia é usada para aumentar a temperatura do gás (∆U > 0) e outra parte promove a expansão do gás (W > 0).
- Se o gás perder calor (Q < 0), parte dessa energia é usada para diminuir a temperatura do gás (∆U < 0) e outra parte promove a compressão do gás (W < 0).
Exercício Resolvido 2: Sob condições de pressão constante, certa quantidade de calor Q, fornecida a um gás ideal monoatômico, eleva sua temperatura em ∆T. Quanto calor seria necessário, em termos de Q, para concluir a mesma elevação de temperatura ∆T, se o gás fosse mantido em volume constante?
a) 3Q
b) 5Q/3
c) Q
d) 3Q/5
e) 2Q/5
Resolução: D
Da primeira lei da termodinâmica:


TRANSFORMAÇÃO ADIABÁTICA
Nesse processo, o gás sofre o processo tão rapidamente que não tem tempo para trocar calor Q = 0.
Pela 1ª Lei da Termodinâmica, temos:
∆U = Q – W
∆U = -W
- Se o gás sofrer uma expansão (W > 0), sua temperatura será reduzida (∆U < 0).
- Se o gás sofrer uma compressão (W < 0), sua temperatura será elevada (∆U > 0).
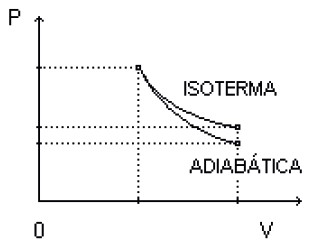
Exemplo 1: Quando você pressiona o spray de um aerossol (desodorante, por exemplo), a superfície fica mais gelada, pois esse processo é adiabático: o gás se expande, portanto a temperatura diminui.
Exemplo 2: Ao encher um pneu usando uma bomba, você verifica o processo inverso. A bomba é aquecida, pois, com a compressão do gás, a temperatura aumenta.
Observação: Somente para essa transformação, podemos usar a Equação de Poisson


O trabalho de uma transformação adiabática pode ser calculado pelas seguintes expressões:

Exercício Resolvido 3: Um gás ideal monoatômico, com n mols e iniciante na temperatura absoluta T, sofre uma expansão adiabática até que sua temperatura fique a um terço de sua temperatura inicial.
Logo, o gás:
a) Absorveu uma quantidade de calor igual a nRT.
b) Se expandiu isobaricamente.
c) Realizou trabalho liberando uma quantidade de calor igual a nRT.
d) Se expandiu aumentando sua energia interna de nRT.
e) Realizou trabalho e sua energia interna diminuiu de nRT.
Resolução: E
Como o gás sofreu uma expansão, ou seja, aumentou o volume, então ele realizou trabalho, mas o processo foi adiabático, isto é, sem haver troca de calor com o meio externo, portanto o trabalho realizado pelo gás foi à custa de sua energia interna.
EXPANSÃO LIVRE
Imagine um frasco de perfume aberto em determinado momento. Aos poucos outras pessoas no mesmo ambiente começarão a sentir o cheiro, pois o gás confinado no recipiente irá se expandir até ocupar todo o volume do recipiente. Esse processo é denominado expansão livre, pois o gás não sofre resistência ao seu movimento, portanto não há realização de trabalho. Esse processo também é adiabático e portanto, pela 1ª Lei da Termodinâmica, a variação de energia interna também é nula.
W = 0
Q = 0
∆U = 0

Observação: Esse processo não pode ser desenhado em um diagrama de Pressão × Volume.




