Os capítulos anteriores fornecem uma base para o entendimento das reações químicas, e estas serão estudadas qualitativamente a partir de agora.
Os fenômenos químicos são também chamados de reações químicas. Dizemos, então, que:
a) na síntese da água, o gás hidrogênio reagiu como gás oxigênio formando água;
b) no ataque do ácido nítrico sobre o cobre metálico, o ácido reagiu com o cobre produzindo água, nitrato de cobre (II) e dióxido de nitrogênio;
c) na queima do magnésio, este metal reagiu com gás oxigênio formando óxido de magnésio.
Observação: As reações químicas são representadas graficamente pelas EQUAÇÕES QUÍMICAS.
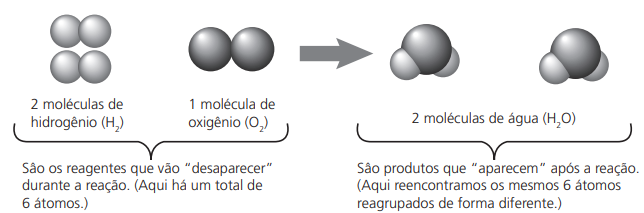
Podemos representar essa reação de maneira simplificada, escrevendo:
2H2 + O2 ⟶ 2H2O
A essa representação damos o nome de equação química.
EQUAÇÃO QUÍMICA
Equação química é a representação gráfica de uma reação química.
Exemplo:
Observação:
Em todas as equações químicas notamos:
Em soma, temos:
aA + bB → cC + dD
1º membro: reagente, A + B
2º membro: produto, C + D
“→” indica o sentido da reação.
a, b, c, d → são os coeficientes da reação.
A, B, C, D → são as substâncias.
OBSERVAÇÕES COMPLEMENTARES
a) FÓRMULAS (H2 ; O2 ; H2O) que indicam quais são as substâncias participantes da reação química.
No primeiro membro, aparecem os REAGENTES, isto é, as substâncias que “entram” em reação; no segundo membro, aparecem os PRODUTOS, isto é, as substâncias que são “formadas” pela reação.
b) COEFICIENTES (2, 1, 2) que indicam a proporção de moléculas que participam da reação.
(Não é costume escrever o coeficiente 1, que fica, então, subentendido). O objetivo dos coeficientes é igualar o número total de átomos de cada elemento, no primeiro e no segundo membros da equação.
CONCLUSÃO: as fórmulas dão um sentido qualitativo, enquanto os coeficientes dão um sentido quantitativo às equações químicas.
c)
- No primeiro membro devem aparecer as substâncias que reagem, são reagentes.
- No segundo membro devem aparecer as substâncias que são formadas ou produzidas pela reação.
d) EQUAÇÃO IÔNICA
Quando uma reação envolve substâncias iônicas ou ionizadas, podemos escrever apenas os íons que nos interessam na explicação do fenômeno químico.
Exemplo:
H+ + Cℓ– → HCℓ
H+ + OH– → H2O




