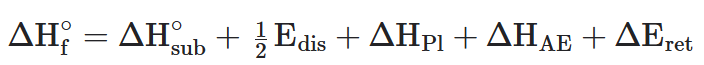ENTALPIA DE FORMAÇÃO
Reação de Formação – É a síntese total de uma determinada substância, ou seja, é a obtenção da substância a partir de substâncias elementares (substâncias simples).
Exemplo: Formação da Amônia (NH3) − N2 + 3H2 → 2 NH3
Estado Padrão – é o estado físico e/ou alotrópico de maior abundância de uma determinada substância na pressão e temperaturas padrão (1 atm e 298 K).
Exemplos:

I. ENTALPIA PADRÃO DE FORMAÇÃO (∆H°F)
É a variação de entalpia de uma reação de formação de 1 mol de uma substância numa dada pressão e temperatura em que todos as substâncias se encontram nas condições padrão.
Exemplos:

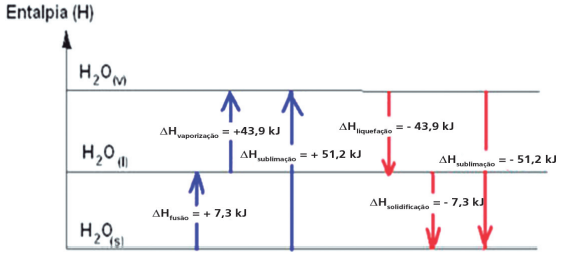
Relação entre entalpia e estado físico: ΔHF(solido) < ΔHF(liquido) < ΔHF(gasoso)
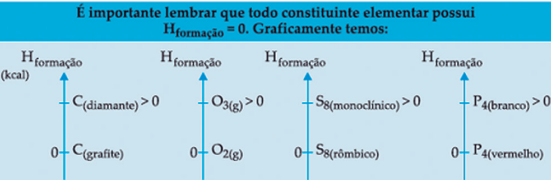
A Entalpia de formação de uma substância elementar no estado padrão é sempre igual a ZERO.
II. ENTALPIA PADRÃO DE COMBUSTÃO (∆H°C)
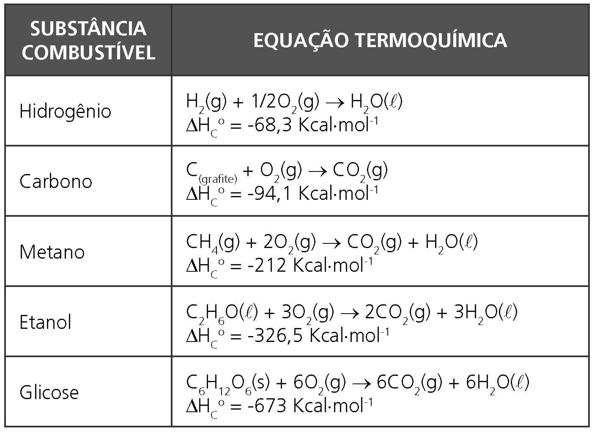
É a variação de entalpia de uma reação de combustão total de 1 mol de uma substância, combustível, numa dada pressão e temperatura em que todos as substâncias se encontram nas condições padrão.
Exemplos:
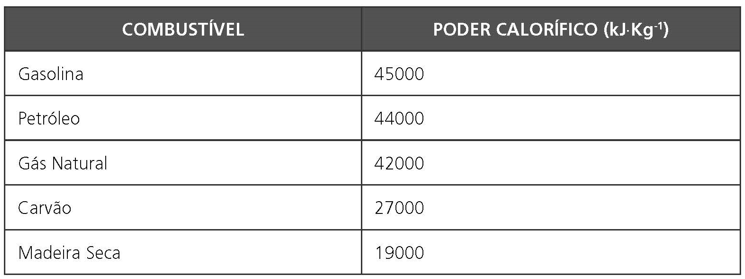
III. PODER CALORÍFICO DE UM COMBUSTÍVEL
É a quantidade calor liberada na combustão de uma substância ou mistura combustível pelo consumo de uma unidade de massa.
Exemplos:
ENTALPIA OU ENERGIA DE LIGAÇÃO (∆HL)
É a quantidade de energia absorvida por 1 mol de uma determinada substância, no estado gasoso, necessária para promover o rompimento de todas as suas ligações químicas.
Exemplo: ácido propanoico
C3H6O2(g) + ΔHL → 3C(g) + 6H(g) + 2O(g)
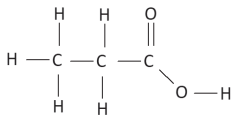
ΔHL=5(C−H)+2(C−C)+(C=O)+(O−H)
Para quebrar Ligações → Absorção de Energia → Processo Endotérmico (+)
Para formar Ligações → Liberação de Energia → Processo Exotérmico (-)
Valores de Algumas Energias de Ligação em KJ ⋅ mol-1:

∆H de uma reação química em função dos valores das energias de ligação:
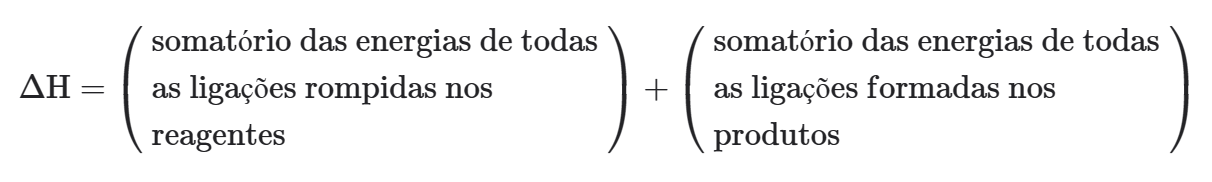
Observação: Normalmente são fornecidos valores de energia ligação levando-se em conta somente o fenômeno de quebra ou de formação. Desta forma, se torna mais conveniente a expressão:
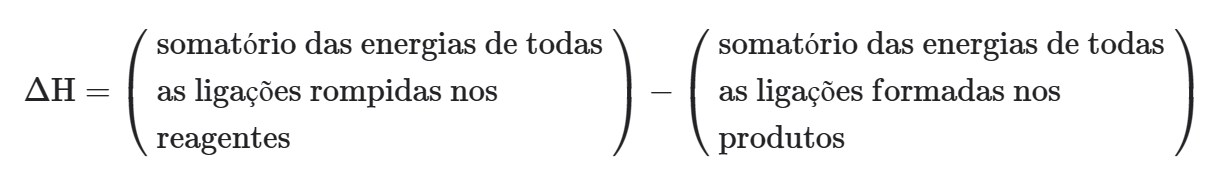
Exemplo:
Considerando os valores de energia de ligação da tabela acima, determine o ∆H da reação:
H2(g) + Cl2(g) → 2HCℓ(g)
Resolução:
Energia total quebrada nos reagentes = (H − H) + (Cℓ − Cℓ) = (432) + (243) = 675 KJ′ ⋅ mol−1
Energia total formada nos produtos =2(H − Cℓ) = 2(431) = 862 KJ ⋅ mol−1
ΔH = (675) − (862) = −187 KJ ⋅ mol−1
OUTROS TIPOS DE CALORES OU ENTALPIAS
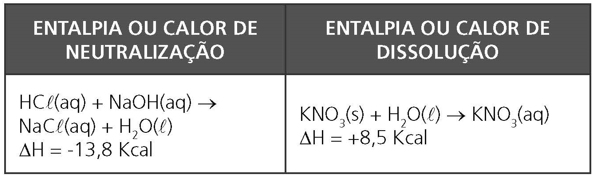
LEI DE HESS
“A Variação de entalpia de uma reação química depende exclusivamente de seus estados final e inicial.”
Exemplo:
Determine a variação de entalpia da reação de hidrogenação total do acetileno (ou etino):
C2H2(g) + 2H2(g) → C2H6(g)
Sendo dados os seguintes valores de entalpias:
Entalpia de formação da água líquida igual a -68 Kcal ⋅ mol-1.
Entalpia de combustão do acetileno gasoso igual a -311 Kcal ⋅ mol-1.
Entalpia de combustão do etano gasoso igual a -373 Kcal ⋅ mol-1.
Escrevendo as equações:
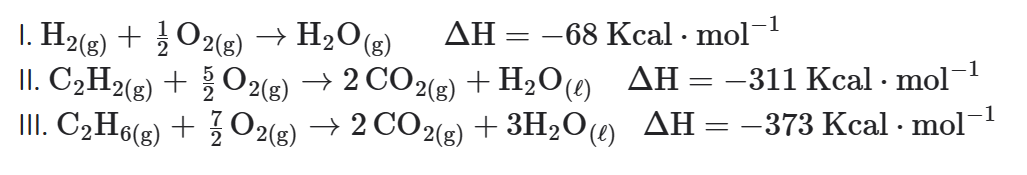
Procedimentos:
- Duplicando a equação I
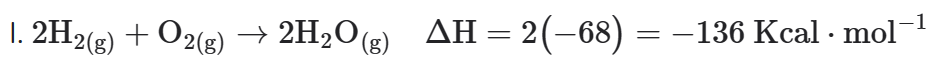
- Reescrevendo a equação II
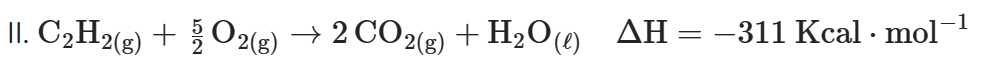
- Invertendo a equação III
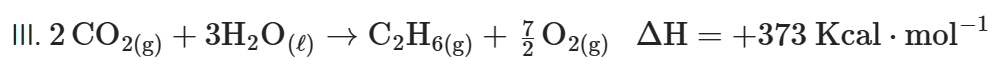
Somando as equações obtidas, eliminando os termos em posição simétrica, vamos obter a equação procurada. Desta forma, a entalpia da reação é a soma dos valores obtidos:
C2H2(g) + 2H2(g) → C2H6(g)
ΔH=(−136) + (−311) + (+373) =−74 Kcal ⋅ mol−1
CICLO DE BORN – HABER
Exemplo: Cloreto de Sódio (NaCℓ)
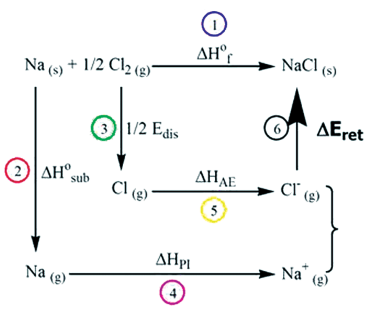
Pela Lei de Hess: