PRINCÍPIO DE THOMPSEN E BERTHELOT
“Dentre um conjunto de reações químicas possíveis, ocorrerá primeiro, espontaneamente, aquela que for mais exotérmica.”
Este, de fato, não é o único critério que deve ser levado em conta para prever a espontaneidade de uma reação.
ENTROPIA(S)
Procura estabelecer uma medida da desordem de uma transformação.
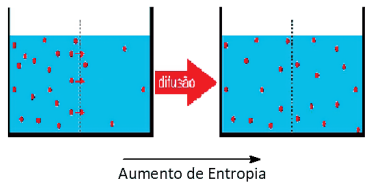
Uma transformação ou uma reação química tende a ser mais espontânea quando se verifica um aumento do seu grau desordem e, consequentemente, um aumento de entropia.
Exemplos:
I. Equilíbrio Térmico

II. Difusão
III. Mudança de Estado Físico

CÁLCULO DA VARIAÇÃO DE ENTROPIA (∆S)
/entropias%20-%201.png)
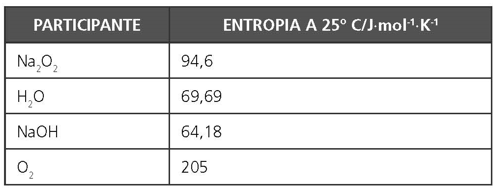
ENTROPIA PADRÃO (S°)
- A entropia de uma substância só seria igual a zero se a mesma se apresentasse na forma de um cristal perfeito e na temperatura de 0 K.
- Mede-se então a quantidade de calor necessária para aquecer a substância desde o zero absoluto (suposto) até 25º C ou 298 K.
Ela também pode ser determinada, numa reação química, em função das energias livres dos componentes participantes.
I. CÁLCULO DO ∆S DE UMA DADA TRANSFORMAÇÃO
Considere a transformação representada pela equação abaixo:
(x)A + (y)B → (z)C + (w)D, onde x, y, z e w representam os coeficientes (número de mols) de cada espécie participante da transformação.
/entropias%20-%202.png)
ENERGIA LIVRE DE GIBBS (∆G)
De forma definitiva, a espontaneidade de uma reação química esta relacionada com seus valores ∆H e ∆S. Para uma reação endotérmica com o ∆S é negativo, fica evidente a não espontaneidade, como também para uma reação exotérmica com o ∆S positivo também fica evidente a espontaneidade, mas quando ∆H e ∆S apresentam o mesmo sinal , como seria prevista a sua espontaneidade?
Gibbs propôs uma função de estado que leva em consideração esses dois fatores:

/entropias%20-%203.png)

A Energia Livre de Gibbs (G) é uma grandeza termodinâmica, cuja variação (∆G) corresponde à máxima energia útil possível de ser retirada por um sistema. Também pode ser determinada, numa reação química, em função das energias livres dos componentes participantes.
CÁLCULO DO ∆G DE UMA DADA TRANSFORMAÇÃO
Considere a transformação representada pela equação abaixo:
(x)A + (y)B → (z)C + (w)D, onde x, y, z e w representam os coeficientes (número de mols) de cada espécie participante da transformação.
/entropias%20-%204.png)
Em transformações isotérmicas podemos relacionar a Energia Livre com as pressões (final → p2 e inicial → p1) ou com os volumes (final → V2 e inicial → V1) pelas equações:
/entropias%20-%205.png)
I. ENERGIA LIVRE PADRÃO DE FORMAÇÃO (ΔG0)
É o valor da Energia Livre a 1 atm e 298 K. Por convenção, a energia livre padrão de formação de elementos é igual a ZERO.

Quando uma substância gasosa se encontra a 298 K, porém numa pressão diferente de 1 atm, p, podemos determinar a sua Energia Livre nessas condições por:
Exemplo:
A conversão de dióxido de enxofre em trióxido de enxofre é uma das etapas de formação da chuva ácida. Dados termodinâmicos, a 25° C são apresentados na tabela.
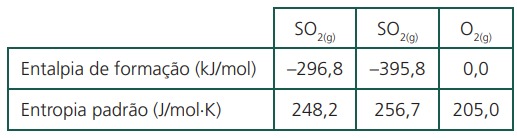
Em relação às características termoquímicas dessa reação, a 25° C, responda:
Essa reação é espontânea a 25° C?
Indique a temperatura limite que descreve a espontaneidade para essa reação.
Resolução:
Equação química:
/entropias%20-%206.png)
Como a reação é exotérmica com variação de entropia positiva, ela será espontânea em qualquer valor de temperatura.




