ENTALPIA(H)
Numa transformação isobárica, como se processa a maioria das reações químicas e numa dada temperatura, podemos escrever a equação do Primeiro Princípio da Termodinâmica da seguinte forma:
U = Q − W → ΔU = Qp − PΔV, onde Qp é a quantidade de calor à pressão constante.
Considerando que sistema se modificou de uma situação 1 para uma outra situação 2, temos:
ΔU = Qp − PΔV
U2 − U1 = Qp − P(V2 − V1)
U2 − U1 = QP − PV2 + PV1
Arrumando os termos, temos:
(U2 + PV2) − (U1 + PV1) = QP
Características do termo U + PV
I. É um conteúdo energético (calorífico).
II. Como é função de três funções de estado, é também uma função de estado.
III. A esse conteúdo energético será denominado de Entalpia (H).
Podemos então escrever a equação:
(U2 + PV2) − (U1 + PV1) = Qp → H2 − H1 = QP
ΔH = Qp
A equação H = U + PV, que define a Entalpia, pode também receber um tratamento diferencial:
H = U + PV → ΔH = ΔU + (PΔV + VΔP) → como a transformação é isobárica (∆P = 0), temos:
ΔH = ΔU + PΔV → ΔU = ΔH − PΔV → Equação do Primeiro Princípio da Termodinâmica numa transformação isobárica.
Numa reação química em que estão presentes componentes gasosos, a variação de volume e, consequentemente, a realização de trabalho, é causada pela variação do número de mols. Podemos então utilizar a Equação de Clapeyron da seguinte forma:
PV = n ⋅ R ⋅ T → PΔV = ΔnRT, o que nos leva a escrever: ΔH = ΔU + ΔnRT
CAPACIDADE CALORÍFICA (C)
Estuda a variação quantidade de calor em função da variação da variação de temperatura.
/Entalpia%20-%201.png)
Observação: Costumamos trabalhar com dois tipos de capacidade calorífica, o Cv, a capacidade calorífica à volume constante, numa transformação isocórica e Cp, a capacidade calorífica à pressão constante, numa transformação isobárica.
Podemos escrever as seguintes equações:
Se U = Q − W → dU = dQ − pdV − vdP
No caso de uma transformação isocórica temos: dU = dQ − vdP(1)
Como U é uma função de estado podemos escrever U=f(T, V).
/Entalpia%20-%202.png)
Como as equações (1) e (2) descrevem a mesma grandeza, energia interna, podemos afirmar que o primeiro da equação 2 descreve a variação da quantidade de calor com a temperatura numa transformação à volume constante, Cv. Desse modo, podemos chegar a seguinte equação:
/Entalpia%20-%203.png)
No caso de uma transformação isobárica temos:
dH = dU − PdV (1)
Como H é uma função de estado podemos escrever H=f(T, P):
/Entalpia%20-%204.png)
Como as equações (1) e (2) descrevem a mesma grandeza, energia interna, podemos afirmar que o primeiro da equação 2 descreve a variação da quantidade de calor com a temperatura numa transformação à pressão constante, Cp. Desse modo, podemos chegar a seguinte equação:
dH = CpdT

Exemplo:
Determine a temperatura máxima, em ºC, que uma chama que queima consumindo 1,6 Kg de butano (C4H10) com quantidade estequiométrica de ar atmosférico que foi inicialmente acionada a 25º C.
Dados:
Massas Atômicas: H=1; C=12; N=14; O=16
Composição volumétrica do ar: 80% de Nitrogênio e 20% de Oxigênio.
Entalpias combustão do butano = -2878 kJ⋅mol-1.
Capacidades caloríficas à pressão constante:
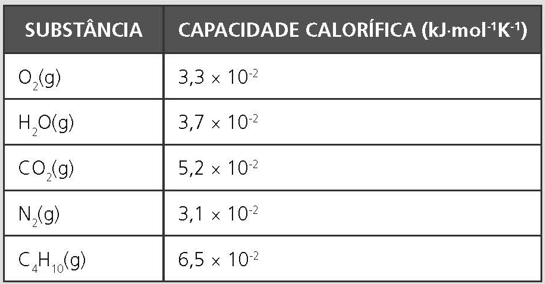
Resolução:
/Entalpia%20-%205.png)
Equação Química de Combustão
Para 1 mol de C4H10 sem a presença de N2:
/Entalpia%20-%206.png)
Para 1 mol de C4H10 com a presença de N2:
/Entalpia%20-%207.png)
Para 20 mol de C4H10 com a presença de N2:
/Entalpia%20-%208.png)
Quantidade de calor produzido → Q = (20)(2878) = 57560 KJ
Essa quantidade de calor aquece os gases presentes nos produtos formados. Então:
/Entalpia%20-%209.png)
CLASSIFICAÇÃO DAS TRANFORMAÇÕES DO PONTO DE VISTA TERMOQUÍMICO
VARIAÇÃO DE ENTALPIA (∆H)
Por se tratar de uma função de estado, a entalpia não é uma grandeza absoluta, logo esta precisa ser medida entre dois pontos (instantes) da transformação analisada. Sendo assim é comum falarmos de variação de entalpia. Quando nos referimos à algum valor de entalpia pontual, é porque foi arbitrariamente escolhido um valor que servirá como referencial.
ΔH = H(estado final) − H(estado inicial)
I. CÁLCULO DO ∆H DE UMA DADA TRANSFORMAÇÃO
Considere a transformação representada pela equação abaixo:
(x)A + (y)B → (z)C + (w)D, onde x, y, z e w representam os coeficientes (número de mols) de cada espécie participante da transformação.
/Entalpia%20-%2010.png)
EAÇÕES (OU TRANSFORMAÇÕES) ENDOTÉRMICAS

REAÇÕES (OU TRANSFORMAÇÕES) EXOTÉRMICAS

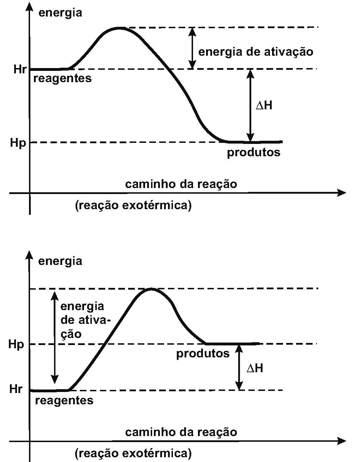
I. ENERGIA DE ATIVAÇÃO (EAT)
É uma quantidade de energia absorvida pelas moléculas dos reagentes necessária para promover a quebra de ligações químicas que originará a formação das moléculas dos produtos.
Exemplo:
01. O gráfico abaixo ilustra uma transformação 100 mols de gás ideal monoatômico recebem do meio exterior uma quantidade de calor 18 · 105 J.
Dado: R = 8 J/mol⋅K.
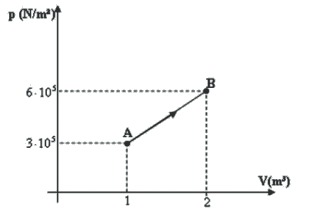
Determine:
a) o trabalho realizado pelo gás;
b) a variação da energia interna do gás;
c) a temperatura do gás no estado A.
Resolução:
a) O trabalho realizado pode ser calculado pela área do gráfico:
/Entalpia%20-%2011.png)
b) U − Q − W → U = 18 · 105 − 4,5 · 105 = 13,5 · 105J ou 13,5 · 105J/100 mol = 13,5 · 103J ⋅ mol−1 = 13,5 KJ ⋅ mol−1
c) PV = nRT → no ponto A → (3 · 105Nm−2) · (1m3) = (100 mol) → T = 37,5 K
02. Considere a reação de combustão completa do propano, a º1 atm e 27º C, representada pela reação química abaixo:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2O(ℓ)
ΔH =−2220 KJ · mol−1
Para um consumo de 2,2 Kg de propano, determine:
O trabalho realizado em KJ.
A energia interna em KJ.
Dado: Massas Atômicas: H = 1; C = 12; R = 8 J/mol⋅K.
Resolução:
a) W = ΔnRT
/Entalpia%20-%2012.png)
b) ΔU = ΔH − W → ΔU(1mol de C3H8) = (−2220000)−(2400)=2222400 J=2.222,4 KJ ⋅ mol−1
ΔU = (50) ⋅ (2222,4) = 111 ⋅ 120 KJ
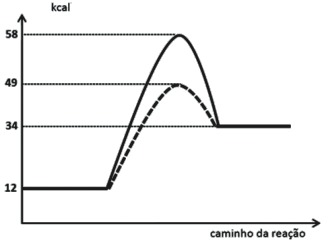
03. Considere os diagramas abaixo:
/Entalpia%20-%2013.png)
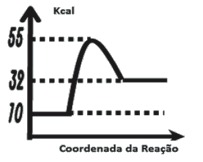
/Entalpia%20-%2014.png)
a) Para a reação I, calcule o valor da variação de entalpia e da energia de ativação.
b) Para a reação II, calcule os valores da energia de ativação na ausência e na presença de catalisador.
Resolução:
Observando os gráficos:
/Entalpia%20-%2015.png)




