ENERGIA
O conceito de energia é extremamente confuso e intuitivo. Ele está associado a ideia de trabalho, que será abordado mais adiante. Em uma visão formal, energia é tudo aquilo que seja capaz de realizar um certo trabalho.
A energia total de um sistema, ou mesmo no Universo é constante, logo ela não pode ser criada ou destruída, apenas transformada de um tipo de energia em outro.
CALOR (Q)
Outra grandeza que também apresenta uma definição empírica é o calor. O calor está associado à variação de temperatura em sistemas abertos e fechados. Desta forma, é necessário a transferência de energia ente o sistema e a vizinhança. Os sistemas adiabáticos não permitem esse estudo.

TEMPERATURA(T)
É muito comum a medida de temperatura através de um termômetro por exemplo. Devemos entender que esse instrumento de medida se encontra nas vizinhanças procurando registrar informações sobre o sistema durante uma determinada transformação dele. A Teoria Cinética dos Gases define a temperatura como a energia cinética média das partículas presentes no sistema. Exemplo, para um gás ideal monoatômico, a energia cinética média de suas n moléculas, Ec, em função da temperatura absoluta, T, é dada por:

Observação:
Para uma molécula do gás, a quantidade de matéria, em mol, para uma molécula é igual a 1/6,02 · 1023. Sendo assim a equação acima fica:

CALOR SENSÍVEL E CALOR LATENTE
CALOR SENSÍVEL
Está diretamente relacionado como o aumento da temperatura.
Quantidade de Calor Sensível (QS)
Essa quantidade de calor é diretamente proporcional à variação de temperatura.
QS = k ⋅ ΔT → A constante de proporcionalidade K, é proporcional à massa de material aquecido ou resfriado.
Qs = m ⋅ c ⋅ ΔT→c é denominado de calor específico. O seu valor depende da natureza química do material.
CALOR LATENTE
Apesar de ser intuitivo que a variação da quantidade de calor poderia variar a temperatura, esse fato não é uma verdade absoluta quando tratamos de uma mudança de estado físico. Nesse caso, a quantidade de calor depende da massa de material do sistema já que a temperatura permanece constante durante a transformação no caso de uma substância pura.
Quantidade de Calor Latente (QL)
QL = m ⋅ L → onde L é denominado de calor latente e depende da natureza química do material.
Podemos de (QL)fusão = m ⋅ Lfusão e (QL)vaporização = m ⋅ Lvaporização.
TRABALHO (W)
O trabalho é uma manifestação do sistema em relação à sua vizinhança.
A definição primitiva de trabalho vem da Mecânica Clássica. Quando um corpo recebe a ação de uma força, F, ele altera a característica de seu movimento, se fato implicar num deslocamento (∆s), ele estará realizando um trabalho que pode ser, simplificadamente, dado por:
W = F ⋅ Δs
Para os sistemas de muitas partículas, em partículas os gases, a força, F, pode ser relaciona com a pressão do gás, P, e a área da seção reta, A, em que a força está sendo aplicada num dado sistema.
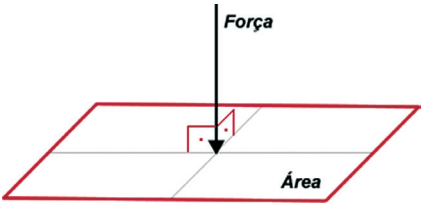

RANSFORMAÇÃO ISOBÁRICA → PRESSÃO CONSTANTE
I. TRABALHO DE EXPANSÃO
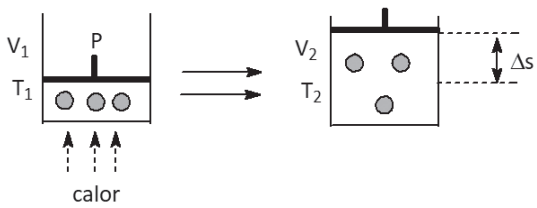
W = F ⋅ Δs = F ⋅ A ⋅ ΔV = P ⋅ ΔV = P ⋅ (V2 − V1) → como V2 > V1 → W(expansão ) > 0
II. TRABALHO DE COMPRESSÃO
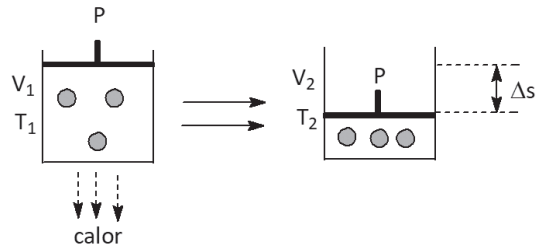
W = F ⋅ ΔS = F ⋅ A ⋅ ΔV = P ⋅ ΔV = P ⋅ (V2 − V1) como V2 < V1 → W(contração) < 0
Considerando uma variação infinitésima de volume, podemos escrever:

TRABALHO ISOBÁRICO E A EQUAÇÃO DE CLAPEYRON
W = P ⋅ ΔV = Δn ⋅ R ⋅ ΔT
Para W em Joule → R = 8,31 J ⋅ mol−1 ⋅ K−1.
Para W em caloria → R = 2 cal ⋅ mol−1 ⋅ K−1.
As reações químicas, em sua maioria, ocorrem à pressão constante e numa temperatura dada. Logo é razoável afirmar que:
W = P ⋅ ΔV = Δn ⋅ R ⋅ T
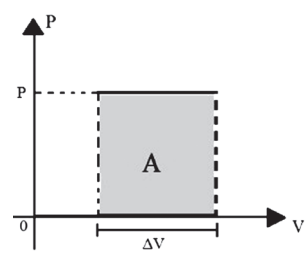
No gráfico pressão × volume, o trabalho pode ser representado pela área que se localiza abaixo da curva.
TRANSFORMAÇÃO ISOTÉRMICA → TEMPERATURA CONSTANTE
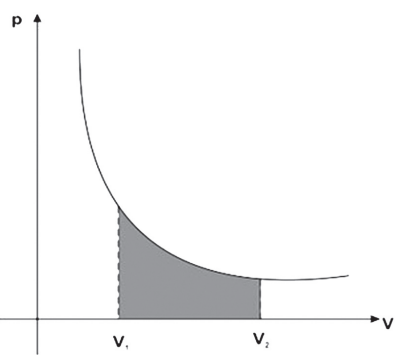
Nesse caso podemos tratar a pressão como uma função do volume dada por:

Usando o trabalho num tratamento diferencial temos:

Integrando a equação diferencial nos limites de V1 a V2, temos:

TRANSFORMAÇÃO ISOCÓRICA → VOLUME CONSTANTE

Como não há variação de volume:
ΔV = 0 → W = 0




