TIPOS DE ENERGIA
As transformações gasosas do capítulo anterior são processos derivados da transformação de energia térmica em energia mecânica ou ao contrário. Vamos conhecer cada uma dessas grandezas energéticas.
ENERGIA INTERNA (U)
Todas as moléculas de qualquer substância estão sempre em movimento, ou seja, possuem energia cinética. A energia interna será o valor que representa essa grandeza física e dependerá apenas de dois fatores: atomicidade (quantos átomos possui cada molécula) e temperatura. Veja a tabela abaixo com as equações para a energia interna de cada tipo de gás.
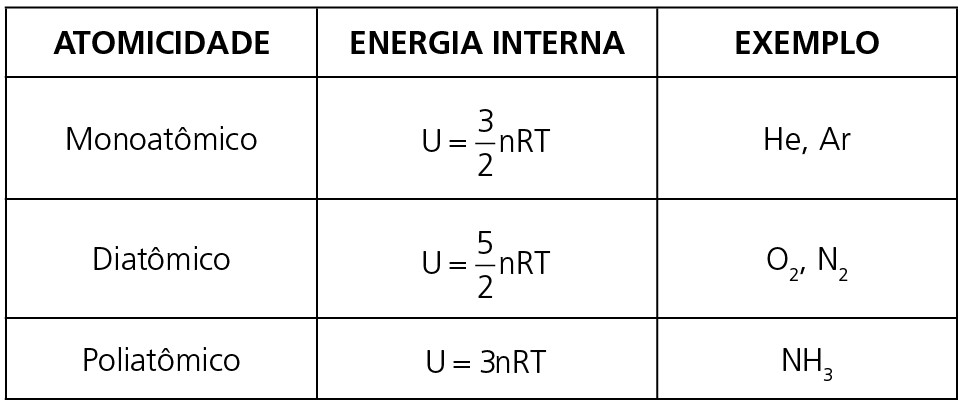
Observação: Em geral, estaremos interessados apenas na variação de energia interna, que para uma substância é diretamente proporcional à variação de temperatura. Observe a relação abaixo para uma determinada transformação gasosa:
- Se a temperatura aumentar, a energia interna também aumenta: ∆U > 0
- Se a temperatura diminuir, a energia interna também diminui: ∆U < 0
- Se a temperatura permanecer constante, a energia interna não varia: ∆U = 0
TRABALHO (W)
O trabalho de um gás possui a mesma definição do trabalho mecânico estudado anteriormente. Ele estará associado à força que o gás realiza (ou sofre) durante o processo de expansão (ou compressão).
Ele pode ser calculado pela expressão:
W = (F)⋅∆x = (P⋅S)⋅∆x = P⋅(S⋅∆x)
W = P⋅∆V
Observação: O sinal do trabalho só depende da variação de volume sofrida pelo gás.
- Se o volume aumentar (expansão), o trabalho é positivo: ∆V > 0 ⇒ W > 0
- Se o volume diminuir (compressão), o trabalho é negativo: ∆V < 0 ⇒ W < 0
- Se o volume não variar, trabalho é nulo: ∆V = 0 ⇒ W = 0
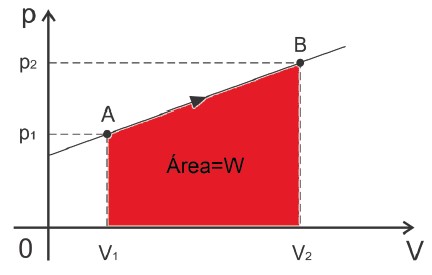
ATENÇÃO: Podemos calcular o trabalho através da área sob a curva de um diagrama Pressão × Volume.
CALOR (Q)
O calor será sensível, pois não haverá mudanças de estado físico. A única diferença para a expressão estudada em calorimetria será o número de mol (em vez da massa) e da capacidade térmica molar (no lugar do calor específico), assim:
Q = n⋅C⋅∆T
- Se o gás receber calor, então Q > 0
- Se o gás ceder calor, então Q < 0
Nesse caso, a capacidade térmica molar depende da atomicidade do gás e do tipo de transformação que o gás está sofrendo (isobárica ou isocórica), vide a tabela abaixo:
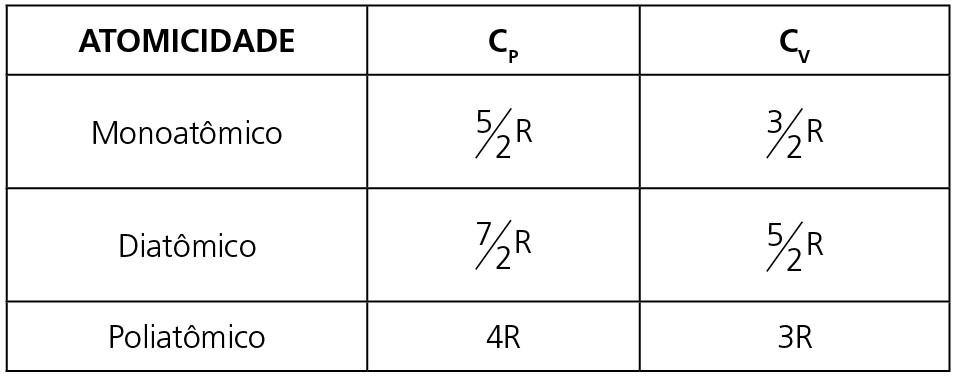
Observação: Chamamos de CP o calor específico molar da transformação isobárica e CV o calor específico molar da transformação isocórica.




