TIPOS DE ENERGIA
As transformações gasosas do capítulo anterior são processos derivados da transformação de energia térmica em energia mecânica ou ao contrário. Vamos conhecer cada uma dessas grandezas energéticas.
ENERGIA INTERNA (U)
Todas as moléculas de qualquer substância estão sempre em movimento, ou seja, possuem energia cinética. A energia interna será o valor que representa essa grandeza física e dependerá apenas de dois fatores: atomicidade (quantos átomos possui cada molécula) e temperatura. Veja a tabela abaixo com as equações para a energia interna de cada tipo de gás.
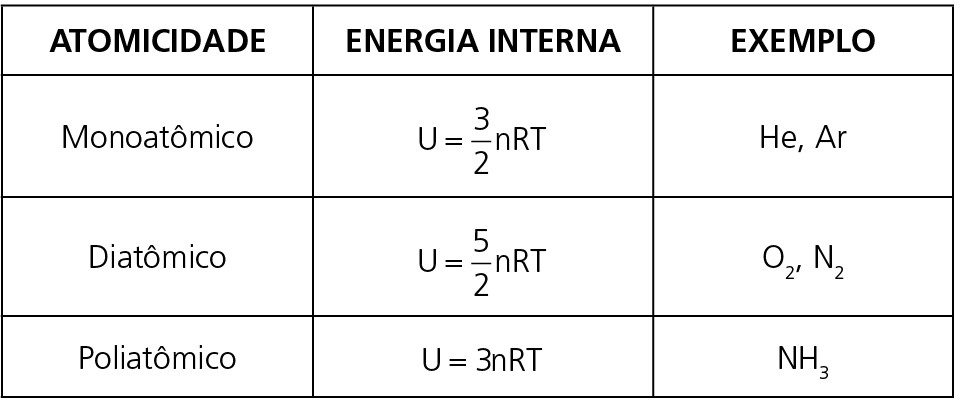
Observação: Em geral, estaremos interessados apenas na variação de energia interna, que para uma substância é diretamente proporcional à variação de temperatura. Observe a relação abaixo para uma determinada transformação gasosa:
- Se a temperatura aumentar, a energia interna também aumenta: ∆U > 0
- Se a temperatura diminuir, a energia interna também diminui: ∆U < 0
- Se a temperatura permanecer constante, a energia interna não varia: ∆U = 0
TRABALHO (W)
O trabalho de um gás possui a mesma definição do trabalho mecânico estudado anteriormente. Ele estará associado à força que o gás realiza (ou sofre) durante o processo de expansão (ou compressão). Ele pode ser calculado pela expressão:
W = (F)⋅∆x = (P⋅S)⋅∆x = P⋅(S⋅∆x)
W = P⋅∆V
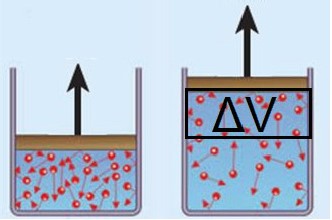
Gás sofrendo expansão
Observação: O sinal do trabalho só depende da variação de volume sofrida pelo gás.
- Se o volume aumentar (expansão), o trabalho é positivo: ∆V > 0 ⇒ W > 0
- Se o volume diminuir (compressão), o trabalho é negativo: ∆V < 0 ⇒ W < 0
- Se o volume não variar, trabalho é nulo: ∆V = 0 ⇒ W = 0
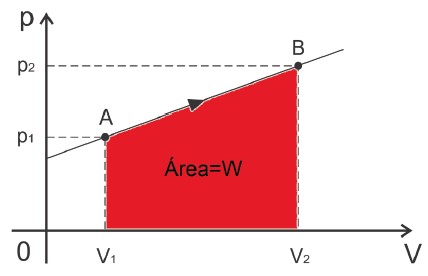
ATENÇÃO: Podemos calcular o trabalho através da área sob a curva de um diagrama Pressão × Volume.
CALOR (Q)
O calor será sensível, pois não haverá mudanças de estado físico. A única diferença para a expressão estudada em calorimetria será o número de mol (em vez da massa) e da capacidade térmica molar (no lugar do calor específico), assim:
Q = n ⋅ C ⋅ ∆T
- Se o gás receber calor, então Q > 0
- Se o gás ceder calor, então Q < 0
Nesse caso, a capacidade térmica molar depende da atomicidade do gás e do tipo de transformação que o gás está sofrendo (isobárica ou isocórica), vide a tabela abaixo:
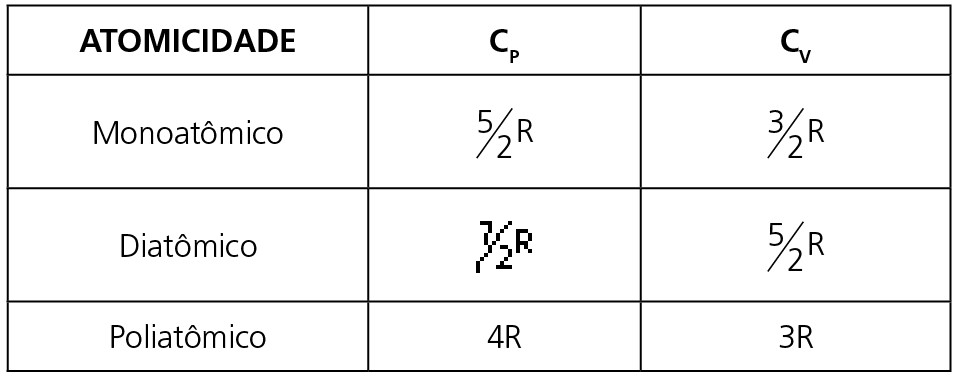
Observação: Chamamos de CP o calor específico molar da transformação isobárica e CV o calor específico molar da transformação isocórica.
PRIMEIRA LEI DA TERMODINÂMICA
Essa é a lei mais importante da termodinâmica e trata-se do princípio de conservação da energia para as transformações gasosas.
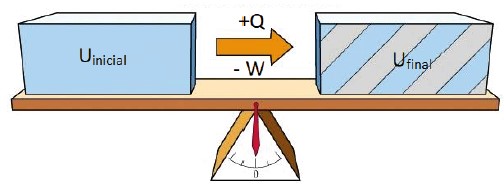
Suponha que um gás possua energia interna (Uinicial) e recebe uma quantidade de calor (Q), gastando parte dessa energia como trabalho (W). Quando sobra de energia para o gás (Ufinal)?

TRANSFORMAÇÕES GASOSAS
Vamos fazer a análise energética das transformações gasosas que estudamos no capítulo anterior e algumas outras especiais:
TRANSFORMAÇÃO ISOTÉRMICA
Como a temperatura se mantém constante, não há variação de energia interna:
∆U = 0
Pela 1ª Lei da Termodinâmica, temos:
∆U = Q – W ⇒ Q – W = 0
W = Q
Assim, todo calor é convertido em trabalho:
- Se o gás receber calor (Q > 0), o gás sofre expansão (W > 0).
- Se o gás perder calor (Q < 0), o gás sofre compressão (W < 0).
Observação: Apenas para os curiosos! O cálculo do trabalho em uma transformação isotérmica envolve a resolução de uma integral e seu resultado final é:

TRANSFORMAÇÃO ISOVOLUMÉTRICA
Como o volume se mantém constante, não há realização de trabalho: W = 0
Pela 1ª Lei da Termodinâmica, temos:
∆U = Q – W = Q – 0
∆U = Q
Assim, todo calor é convertido em energia interna:
- Se o gás receber calor (Q > 0), há aumento da temperatura do gás (∆U > 0).
- Se o gás perder calor (Q < 0), há redução da temperatura do gás (∆U < 0).
TRANSFORMAÇÃO ISOBÁRICA
Com a pressão constante, podemos calcular diretamente o trabalho do gás e em seguida usar a equação de Clapeyron:
W = P⋅∆V = nR⋅∆T
Pela 1ª Lei da Termodinâmica, temos:
∆U = Q – W
Q = ∆U + W
- Se o gás receber calor (Q > 0), parte dessa energia é usada para aumentar a temperatura do gás (∆U > 0) e outra parte promove a expansão do gás (W > 0).
- Se o gás perder calor (Q < 0), parte dessa energia é usada para diminuir a temperatura do gás (∆U < 0) e outra parte promove a compressão do gás (W < 0).
TRANSFORMAÇÃO ADIABÁTICA
Nesse processo, o gás sofre o processo tão rapidamente que não tem tempo para trocar calor Q = 0.
Pela 1ª Lei da Termodinâmica, temos:
∆U = Q – W
∆U = -W
- Se o gás sofrer uma expansão (W > 0), sua temperatura será reduzida (∆U < 0).
- Se o gás sofrer uma compressão (W < 0), sua temperatura será elevada (∆U > 0).
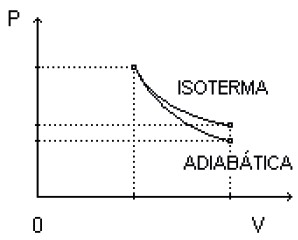
Comparação dos gráficos Pressão × Volume de uma transformação adiabática × isotérmica
Exemplo 1: Quando você pressiona o spray de um aerossol (desodorante, por exemplo), a superfície fica mais gelada, pois esse processo é adiabático: o gás se expande, portanto a temperatura diminui.
Exemplo 2: Ao encher um pneu usando uma bomba, você verifica o processo inverso. A bomba é aquecida, pois, com a compressão do gás, a temperatura aumenta.
Observação: Somente para essa transformação, podemos usar a Equação de Poisson

Em que γ = Cp/Cv é coeficiente de Poisson
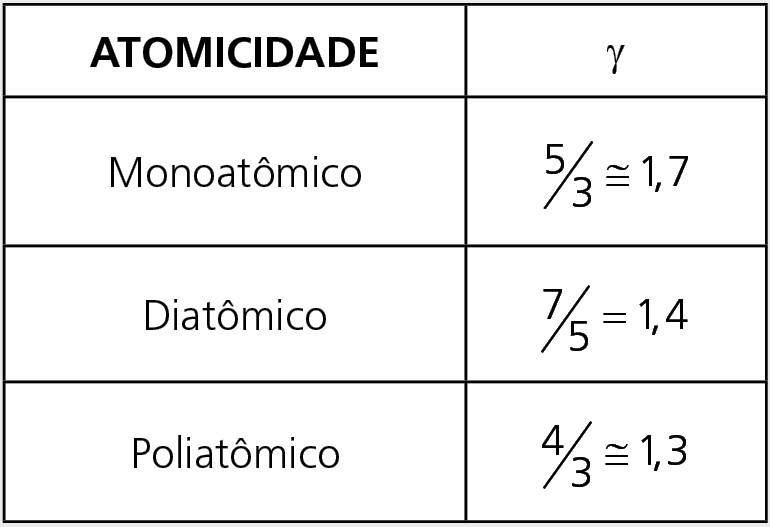
O trabalho de uma transformação adiabática pode ser calculado pelas seguintes expressões:

EXPANSÃO LIVRE
Imagine um frasco de perfume aberto em determinado momento. Aos poucos outras pessoas no mesmo ambiente começarão a sentir o cheiro, pois o gás confinado no recipiente irá se expandir até ocupar todo o volume do recipiente. Esse processo é denominado expansão livre, pois o gás não sofre resistência ao seu movimento, portanto não há realização de trabalho. Esse processo também é adiabático e portanto, pela 1ª Lei da Termodinâmica, a variação de energia interna também é nula.
W = 0
Q = 0
∆U = 0

Representação da expansão livre de um gás
Observação: Esse processo não pode ser desenhado em um diagrama de Pressão × Volume.
MÁQUINAS TÉRMICAS
Uma máquina térmica é um dispositivo capaz de converter energia interna em trabalho mecânico e foi a base da 1ª Revolução Industrial no final do século XIX. Esse trabalho é obtido somente quando o calor flui espontaneamente de uma região de maior temperatura (fonte quente) para uma região de menor temperatura (fonte fria) como descrito no esquema energético abaixo:
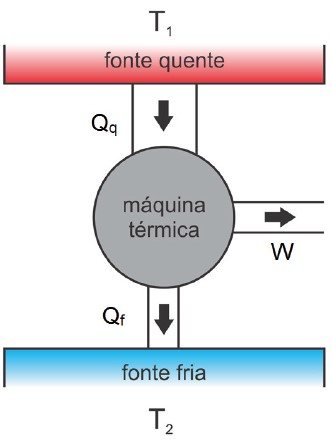
Esquema energético de uma máquina térmica
Existem três grandezas energéticas representadas:
- Fonte quente: regiões a altas temperaturas (uma caldeira com vapor d’água, por exemplo) que fornecem calor (Qq) para a máquina.
- Fonte fria: regiões para onde o excesso de calor (Qf) é rejeitado.
- Trabalho: energia aproveitada para realizar alguma tarefa útil (W).
Para que o equipamento funcione, há um gás que sofre uma transformação cíclica, ou seja, ele começa em um estado inicial A, vai para outros estados e depois retorna ao estado A. Na representação de um diagrama P × V, teremos uma superfície fechada com os pontos inicial e final coincidentes. A área destacada, “interna” à curva, nos fornece o trabalho realizado pelo gás durante a transformação.
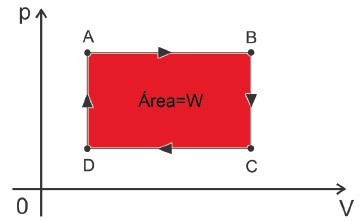
Diagrama Pressão × Volume de uma transformação cíclica
Observação:
- Como não há variação de temperatura ao final do ciclo: ∆Uciclo = 0.
- O ciclo de uma máquina térmica estará sempre no sentido horário.
Usando a 1ª lei da termodinâmica ao longo do ciclo, temos:
∆U = Q – W = 0
Q = W
Também podemos observar pelo balanço energético que:
Qq = Qf + WQq – Qf = Q = W
RENDIMENTO
A segunda lei da termodinâmica (que será abordada mais a frente) nos garante que nenhuma máquina térmica pode converter todo o calor que lhe é fornecido em energia mecânica. Assim, há um aproveitamento parcial do calor ao ser transformado em trabalho chamado de rendimento η e pode ser calculado por duas expressões:

Observação: O rendimento de qualquer máquina térmica é sempre menor que 100%: η < 1.
Curiosidade: No final do século XVIII, o escocês James Watt criou um dispositivo eficiente que convertia calor em trabalho mecânico. A partir daí, a burguesia fez grandes investimentos e sua máquina foi empregada em moinhos, bombas d’água, locomotivas, barcos a vapor e em fábricas, sendo um dos principais fatores que levaram à Revolução Industrial.
Modelo da máquina térmica de James Watt
MOTORES DE COMBUSTÃO INTERNA
Os motores de combustão interna são máquinas térmicas usadas em veículos, exceto os elétricos. Eles possuem um ciclo de queima de combustível para produção de calor e movimento de pistões para realizar trabalho. Vamos ilustrar alguns exemplos:
CICLO OTTO (1876)
Esse é o ciclo dos motores movidos à gasolina e possui 4 tempos (transformações).
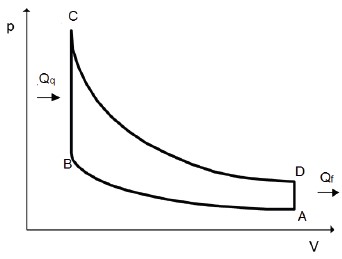
Diagrama P × V do Ciclo Otto
- Começando em O, o combustível e o ar são admitidos no pistão; o ciclo térmico ainda não começou.
- A partir de A, o gás é comprimido adiabaticamente até o ponto B.
- Aquecido isometricamente até o ponto C pela fonte quente.
- Expandido adiabaticamente até o ponto D.
- Resfriado isocoricamente até retornar ao ponto A.
Durante o processo de AB, há um fator de compressão dado pela razão entre o volume inicial do pistão e seu volume quando comprimido, ou seja, r = VA/VB. Esse fator que determina o rendimento do motor à gasolina:

CICLO DIESEL (1900)
Esse é o ciclo dos motores movidos à diesel e também possui 4 tempos (transformações).
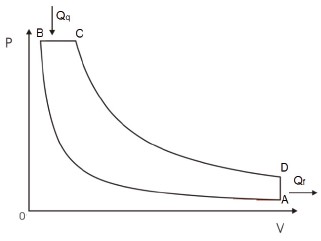
Diagrama P×V do Ciclo Diesel
- Começando no ponto A, o gás é comprimido adiabaticamente até o ponto B.
- Aquecido isobaricamente até o ponto C pela fonte quente.
- Expandido adiabaticamente até o ponto D.
- Resfriado isocoricamente até retornar ao ponto A.
CICLO DE CARNOT
Em 1824, o engenheiro francês Nicolas Léonard Sadi Carnot, analisando o funcionamento das máquinas térmicas, descobriu qual a fração máxima de calor que poderia ser convertida em trabalho. Ou seja, qual o rendimento máximo que uma máquina poderia ter. Essa máquina ideal tem rendimento dado por:

Observação: As temperaturas precisam estar sempre na escala absoluta Kelvin.
E seu ciclo termodinâmico contém 4 etapas que você precisa saber:
- Expansão isotérmica AB na temperatura Tq, absorvendo Qq de calor.
- Expansão adiabática BC até a temperatura Tf.
- Compressão isotérmica BD na temperatura Tf, rejeitando Qf de calor.
- Compressão adiabática DA até a temperatura retornar para Tq.
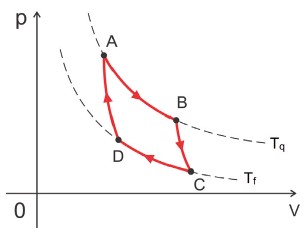
Diagrama P × V do Ciclo de Carnot
Somente nesse ciclo, vale a relação:

Observação: Essa máquina hipotética mostra qual o rendimento máximo de uma máquina térmica que opera entre as temperaturas Tq e Tf. Assim para qualquer máquina térmica real vale a relação:
0 < ηmáquina < ηCarnot < 1
REFRIGERADORES
Um refrigerador é um dispositivo capaz de fazer o calor fluir da fonte fria para a fonte quente. No entanto, esse processo não é espontâneo e necessita do gasto de energia mecânica (trabalho) para que ele funcione. O diagrama energético de um refrigerador está representado na figura abaixo:
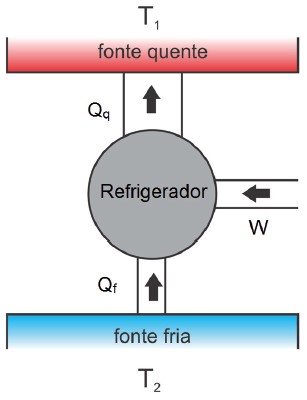
Esquema energético de um refrigerador
Observação:
- Um refrigerador também sofre um processo cíclico, porém no sentido anti-horário
- Como não há variação de temperatura ao final do ciclo: ∆Uciclo=0.
Da primeira lei da termodinâmica, temos:
ΔU = Q – W = 0 ⇒ Q = W
Qq = Qf + W ⇒ Qq – Qf = Q = W
EFICIÊNCIA
O objetivo do refrigerador é retirar calor da fonte fria gastando energia mecânica (trabalho) no processo. Assim um bom refrigerador retira a maior quantidade possível de calor e consumindo a menor quantidade de trabalho. A razão entre essas duas grandezas mede a sua eficiência.

Observação: Em algumas questões, a eficiência também pode ser chamada de rendimento e vice-versa.
Exemplo: Geladeira e ar condicionado são os aparelhos refrigerantes mais comuns.
REFRIGERADOR DE CARNOT
Existe um refrigerador que possui máxima eficiência, chamado de refrigerador de Carnot. Essa eficiência pode ser calculada pela seguinte expressão:

2ª LEI DA TERMODINÂMICA
Apesar de termos estudado processos reversíveis (cíclicos), a maioria dos processos são irreversíveis. Por exemplo, um perfume, após liberado da caixa, não tende a retornar, mas sim se expandir livremente, ocupando o espaço ao redor. De fato, o retorno do perfume ao frasco não viola a 1ª Lei. Então por que o gás tende a se expandir? Por que o processo é irreversível?
As tentativas de melhorar os rendimentos das máquinas térmicas tem tudo a ver com as perguntas acima. Carnot, em 1824, antes mesmo da formulação da 1ª lei (meados de 40), se debruçou diante desse problema. Seus estudos ajudaram na formulação da 2ª lei de Clausius (1850) e Kelvin (1851).
ENUNCIADOS DA 2ª LEI DA TERMODINÂMICA
Kelvin: é impossível realizar um processo cujo único efeito seja remover calor de um reservatório térmico e produzir uma quantidade equivalente de trabalho.
Observação: Perceba que isso não significa que é impossível converter calor inteiramente em trabalho, como muitos autores escrevem! É possível sim converter todo calor em trabalho. Por exemplo, um gás em processo de expansão isotérmica. Sua variação de energia interna é zero, portanto, todo calor absorvido se converteu em trabalho (τ = Q).
Quando Kelvin disse único efeito, significa que o sistema tem que voltar ao estado inicial, ou seja, que o processo é reversível (cíclico). No exemplo acima, da expansão isotérmica, não há contradição ao enunciado de Kelvin, já que o estado inicial se difere do final. Ou seja, para processos reversíveis, considerando um ciclo completo, aí sim, é impossível converter todo calor em trabalho.
Se pudéssemos ter um ciclo que o calor se transformasse completamente em trabalho, teríamos um motor perpétuo, violando a 1ª lei. Para termos uma máquina térmica operando em ciclos, é necessário o fornecimento de calor.
Clausius: é impossível realizar um processo cujo único efeito seja transferir calor de um corpo mais frio para um corpo mais quente.
Observação: Lembrando que novamente aparece a expressão único efeito, ou seja, o processo deve ser cíclico. Se o gás não voltar para o estado inicial, é possível. Por exemplo, podemos colocar um recipiente contendo um gás em contato com um corpo mais frio, que pode absorver calor desse gás caso sofra um processo de expansão isotérmica (ΔU = 0, Q = τ > 0). Em seguida, o gás pode sofrer uma compressão adiabática, até atingir uma temperatura maior que na etapa anterior (essa temperatura mais baixa da etapa anterior é a mesma que o corpo tem, já que estava em contato com o gás). Colocando novamente esse gás em contato com o corpo, que está a uma temperatura mais baixa que gás, o gás pode receber calor por compressão isotérmica (ΔU = 0, Q = τ < 0). Nada impede que o trabalho total seja zero e o estado final é diferente do inicial (sua temperatura aumentou) e recebeu calor de um corpo mais frio.




