CONCEITOS PRELIMINARES
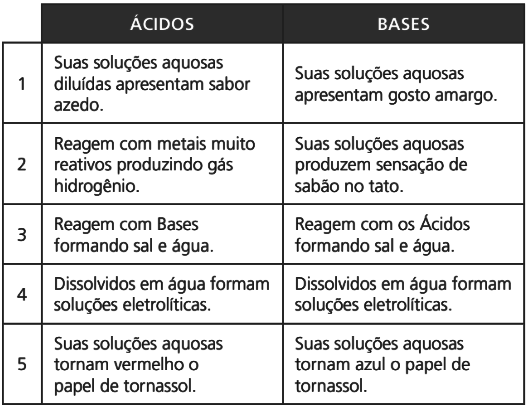
A classificação de um composto em ácido ou base surgiu inicialmente de observações experimentais:
TEORIA DE ARRHENIUS
Arrhenius definia ácido como substâncias hidrogenadas que em solução aquosa se ionizam resultando em íons hidrogênio (H+).
Exemplos:

Observações:
1) O íon hidrogênio, H+, não existe nesta forma em solução aquosa, apresentando-se de fato na forma de íons hidrônio, H3O+. Assim, as equações de ionização de um ácido poderiam ser reescritas da seguinte forma:

2) A neutralização de um ácido por uma base em solução aquosa diluída pode ser generalizada por:

EORIA DE BRÖNSTED – LOWRY
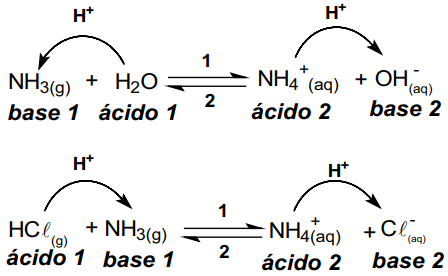
Segundo Brönsted e Lowry, um ácido é uma substância ou íon que pode doar um próton (H+), e uma base é uma substância ou íon que pode aceitar esse próton. Essas reações podem se processar em solventes diferentes da água, ampliando assim o universo de possibilidades em relação à teoria de Arrhenius.
Exemplo:
PARES CONJUGADOS
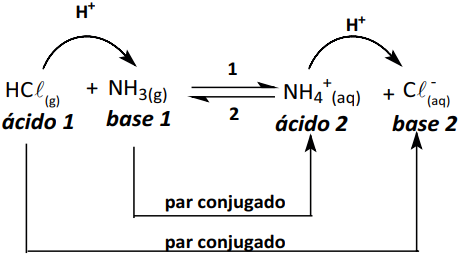
Segundo a teoria de Brönsted e Lowry, são denominados pares conjugados substâncias ou íons que em lados opostos de uma reação diferem por um próton (H+). Um ácido do reagente sempre tem uma base do produto como seu par conjugado e vice-versa.
Exemplo:
TEORIA DE LEWIS
Ácido – Toda espécie capaz de receber pelo menos um par eletrônico com o objetivo de completar a sua estabilidade. Por necessitar de par eletrônico para essas espécies são denominadas, em meio reacional, de eletrófilo ou agente eletrofílico. (Afinidade por elétron).
Os ácidos de Lewis em geral são moléculas cujo átomo central apresenta uma camada de valência com o octeto contraído ou cátions.
Exemplos:
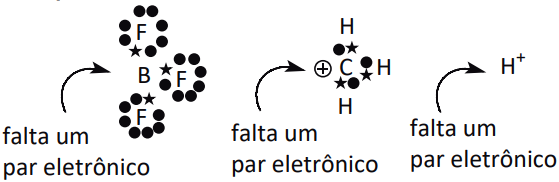
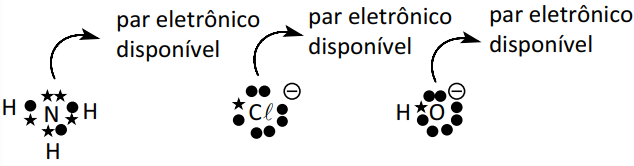
Base – Toda espécie capaz de doar pelo menos um par eletrônico com o objetivo de completar a sua estabilidade. Por apresentar disponibilidade para a doação de par eletrônico, são denominados de nucleófilo ou agente nucleofílico.
Exemplos:
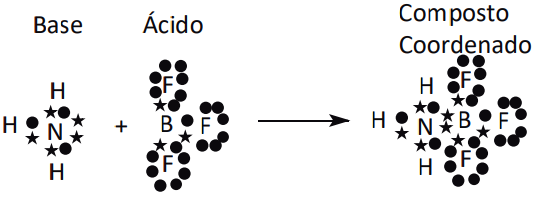
Reação entre um ácido e uma base segundo Lewis
Exercícios resolvidos:
01. Indique em cada uma das reações abaixo, os respectivos pares conjugados.

Resolução:

02. Quando dissolvemos o Na2 S em água, ele dissocia produzindo 2Na++S2-. Os íons sulfeto reagem com a água recebendo um próton. Equacione esse fato e indique os ácidos e as bases envolvidas.
Resolução:

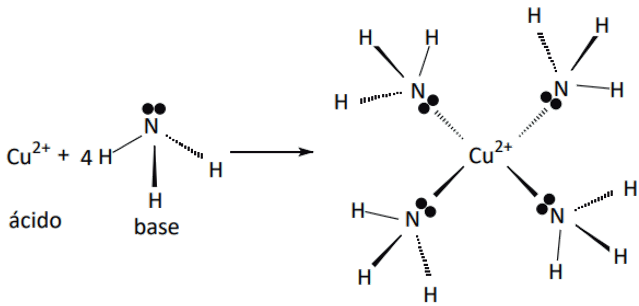
03. Na reação: Cu2+ +4NH3 → [Cu (NH3)4]2+, indique o ácido e a base envolvida.
Resolução: