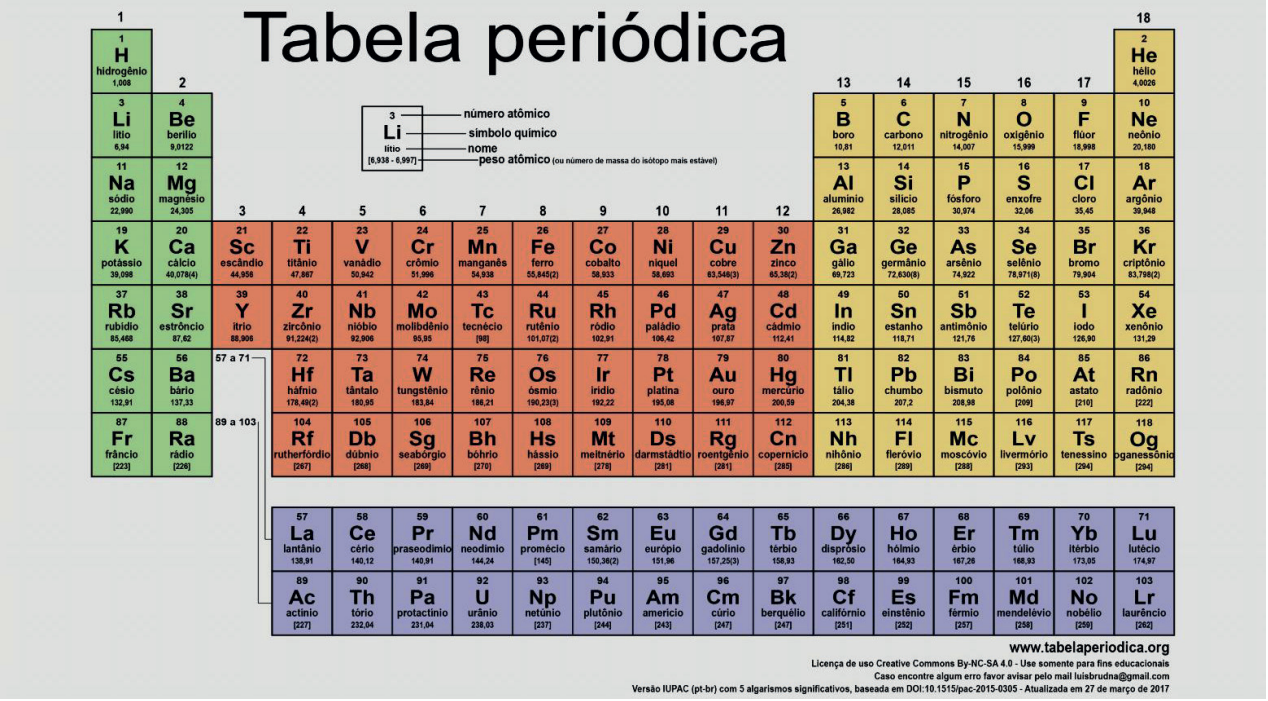
LEI PERIÓDICA
“Quando os elementos são ordenados em ordem crescente de seus NÚMEROS ATÔMICOS, pode-se observar a repetição periódica de muitas de suas propriedades.”
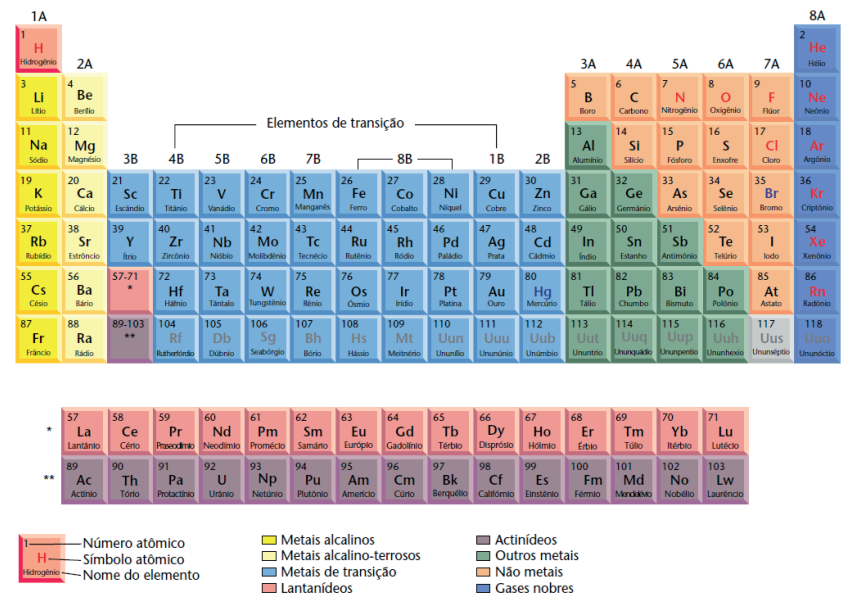
A partir dessa lei, a tabela periódica é organizada de forma definitiva e se apresenta de modo a tornar mais evidente a relação entre as propriedades dos elementos e a estrutura eletrônica deles.
Observação:
A tabela sofreu uma grande modificação quando, em 1940, Glenn Seaborg, em consequência de seu trabalho, descobriu todos os elementos transurânicos (número atômico maior que 92) e colocou a série dos actinídeos abaixo da série dos lantanídeos.
De 1994 em diante, novos elementos foram descobertos, também classificados como transurânicos e sintéticos, pela fabricação artificial. Esses novos elementos são dados a partir do número atômico 110 até 118, o total de elementos que a tabela periódica conta hoje.
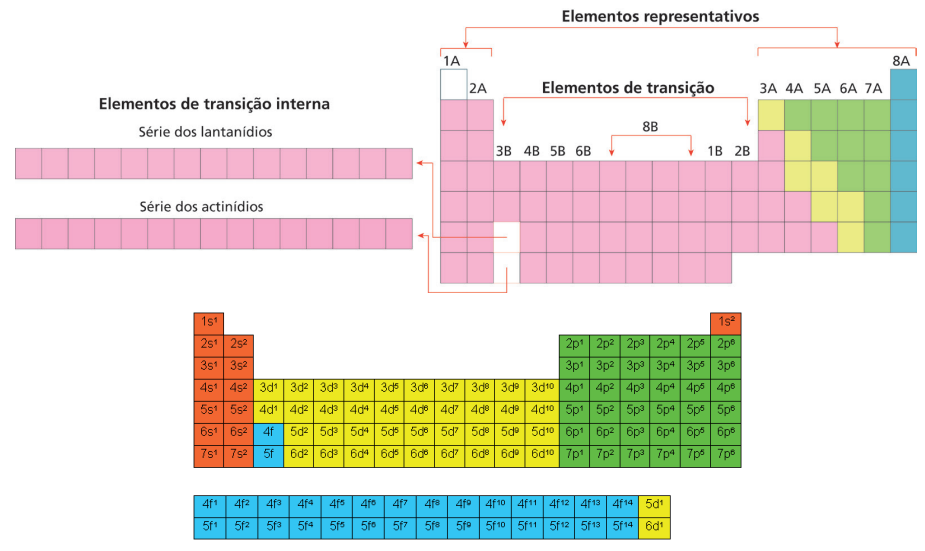
Em 1990, a IUPAC publicou a recomendação final para um novo sistema que não usa letras e os grupos passaram a ser enumeradas com algarismos arábicos de 1 a 18 (da esquerda para a direita). Na figura a seguir, a numeração dos grupos de acordo com este novo sistema é mostrada acima da designação tradicional.
METAIS E AMETAIS (NÃO METAIS)
AS FAMÍLIAS, GRUPOS OU COLUNAS
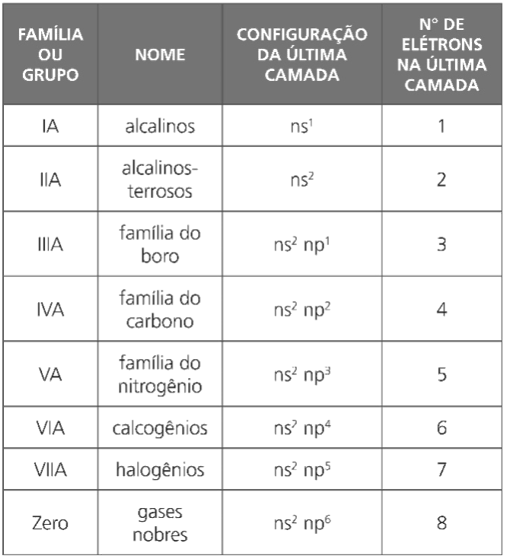
Cada coluna vertical da tabela periódica constitui o que chamamos família ou grupo de elementos; são, ao todo, dezoito.
Uma família corresponde a elementos que apresentam certa similaridade na sua estrutura eletrônica da última camada, o que acarreta certa semelhança de comportamento químico.
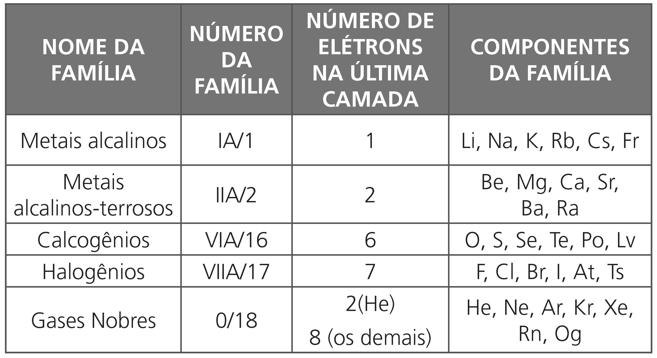
Logo, podemos concluir que os átomos de uma família apresentam:
- mesma configuração eletrônica na última camada (camada de valência);
- propriedades químicas semelhantes.
OS PERÍODOS OU SÉRIES
Cada fila horizontal da tabela periódica constitui o que chamamos período ou série de elementos.
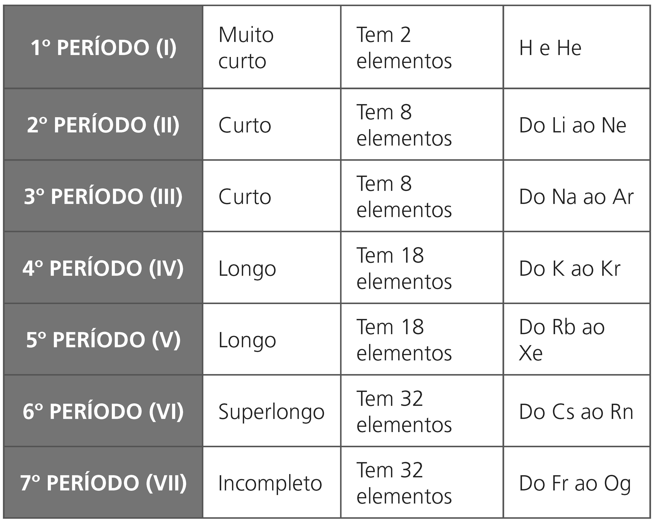
Cada período corresponde ao número de camadas eletrônicas existentes nos elementos que o constituem. Os períodos são sete.
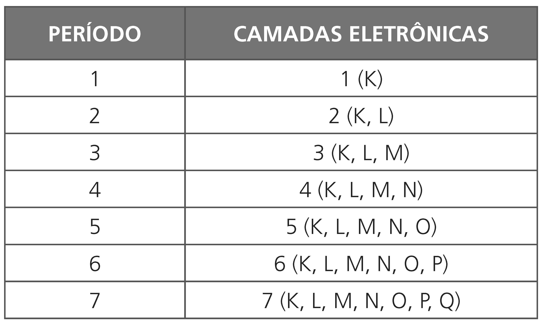
CLASSIFICAÇÃO DE PERÍODOS
Observação:
- Na configuração geral de uma família, a letra n, além de ser o número quântico principal da última camada, também será o número do período ao qual o elemento pertence.
Exemplo:

- Bloco A ⇒ “n” A, no qual “n” é o número de elétrons da camada de valência do átomo.
- As séries são colocadas abaixo da tabela como apêndices.
NOTAS:
- Lantânio (La) e Actínio (Ac) não pertencem às séries.
- Essas séries são chamadas Elementos de Transição Interna.
- Os lantanídeos também são chamados lantanoides ou terras-raras.
- Os actinídeos também são chamados actinoides.
- Os termos lantanoide e actinoide foram recomendados pela IUPAC.
CLASSIFICAÇÃO DOS ELEMENTOS
QUANTO À SUA ESTRUTURA ELETRÔNICA
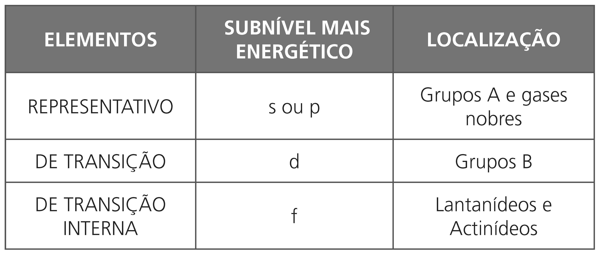
O quadro abaixo mostra os subníveis de maior energia dos átomos e a posição dos respectivos elementos na tabela periódica:
QUANTO ÀS CARACTERÍSTICAS E PROPRIEDADES
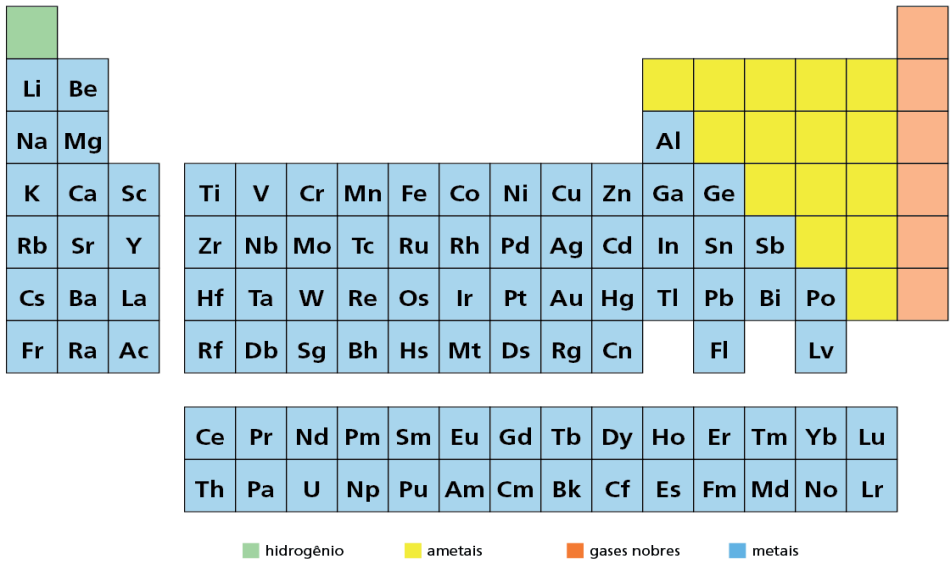
METAIS – AMETAIS – GASES NOBRES
Outra classificação importante que pode ser localizada na tabela periódica, é feita com base em propriedades gerais dos elementos.
Os metais, em torno de 84, são os mais numerosos elementos conhecidos.
Estão situados do centro para a esquerda da tabela periódica.
São bons condutores de eletricidade e calor. Apresentam um brilho típico, chamado brilho metálico; podem ser reduzidos a lâminas (maleabilidade); podem ser reduzidos a fios (ductibilidade). Apresentam, via de regra, poucos elétrons (menos de 4) na última camada. Tendem a perder elétrons; são todos sólidos (25°C), com exceção do mercúrio, que é líquido.
Os não metais são poucos, somente 15.
Estão situados à direita da tabela periódica, antes da família dos gases nobres.
Em geral, são maus condutores de corrente elétrica e calor; não apresentam brilho metálico, não podem ser reduzidos a lâminas e fios. Apresentam, via de regra, muitos elétrons (mais de 4) na última camada. Tendem a ganhar elétrons; não apresentam propriedades muito uniformes. Já os gases nobres possuem uma alta estabilidade e apresentam baixa reatividade, sendo considerados, até pouco tempo, inertes.
CLASSIFICAÇÕES COMPLEMENTARES
ELEMENTOS ARTIFICIAIS
Após o elemento urânio (92U), todos os elementos químicos situados na tabela periódica são artificiais, ou seja, não existem no nosso planeta e são produzidos em laboratório: são os elementos transurânicos.
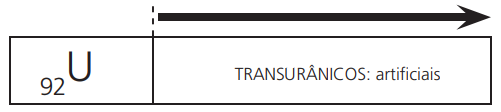
Com o número atômico inferior a 92, temos alguns poucos elementos artificiais: frâncio (87Fr), astato (85At), tecnécio (43Tc) e promécio (61Pm). Tais elementos são denominados cisurânicos.
ELEMENTOS RADIOATIVOS
Os elementos cujos isótopos mais abundantes são radioativos estão situados, na tabela, do polônio em diante.




