CRISTALIZAÇÃO OU EVAPORAÇÃO DO SOLVENTE
É o procedimento que se usa na extração do sal salinas. A água do mar, rica em cloreto de sódio ou sal de cozinha, é armazenada em tanques e exposta a evaporação, muita vezes acelerada por cata-ventos. Com o passar do tempo, a água evapora e o sal se deposita.

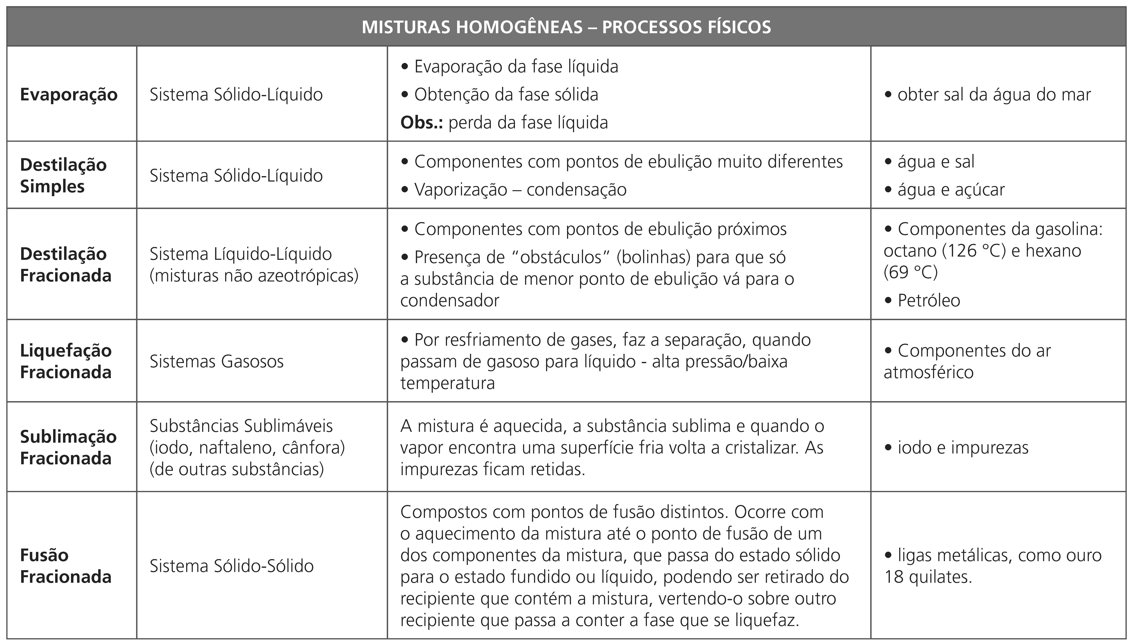
DESTILAÇÃO SIMPLES
É um procedimento laboratorial que consiste da montagem de um equipamento específico, o destilador. O destilador é composto de bico de Bunsen ou manta de aquecimento, balão de saída lateral ou balão de destilação simples, condensador, frasco coletor, que pode ser um Béquer ou Erlenmeyer e termômetro. A mistura colocada no balão de saída lateral é aquecida até a temperatura de ebulição do líquido, observada no termômetro. Ao entrar em ebulição, os vapores resultantes da vaporização do líquido entram no condensador. O condensador é um equipamento que apresenta um tubo interno e, na parte externa, um segundo tubo denominado bulbo ou camisa. As partes, interna e externa, permitem a ocorrência de trocas de calor; dessa forma, faz-se o enchimento do bulbo com água fria, e através das mangueiras de entrada e saída de água, é possível a manutenção da água numa temperatura baixa. Esse procedimento resfria e condensa o vapor que está contido no tubo interno, e o líquido destilado é gotejado no frasco coletor.

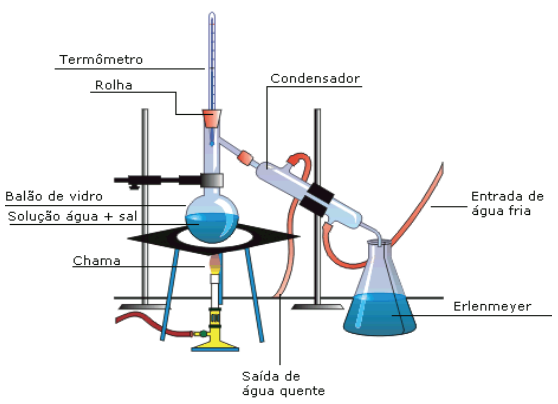
DESTILAÇÃO FRACIONADA
Usa-se também um destilador em procedimentos laboratoriais. A diferença entre a destilação fracionada da simples está na substituição do balão de saída lateral pelo balão de pescoço curto e a inclusão da coluna de fracionamento. Os demais componentes do destilador são idênticos.
A coluna de fracionamento é necessária porque ocorre vaporização parcial de todos os líquidos presentes da mistura, compondo uma mistura de vapores em proporções diferentes dos componentes; o líquido mais volátil apresenta uma maior quantidade dessa mistura, enquanto que o líquido menos volátil se apresenta em menor quantidade. A coluna de fracionamento consiste num tubo de vidro que apresenta regiões específicas, denominada pratos ou pratos teóricos, que promove a troca de calor dos vapores, resfriando-os e, consequentemente, condensando-os. Quanto maior o número de pratos, o que aumenta o comprimento da coluna, maior a capacidade de separação da mesma. O vapor oriundo do líquido de maior volatilidade apresenta uma elevada energia cinética comparada aos demais, esse fato permite que o mesmo consiga superar os obstáculos impostos pelos pratos e alcançar a parte superior da coluna abandonando a mesma e entrando no condensador para finalmente ser destilado no coletor de saída. Esse processo se repete com cada componente da mistura.
Misturas líquidas cuja composição resulta num comportamento azeotrópico não conseguem ser separadas por destilação fracionada.

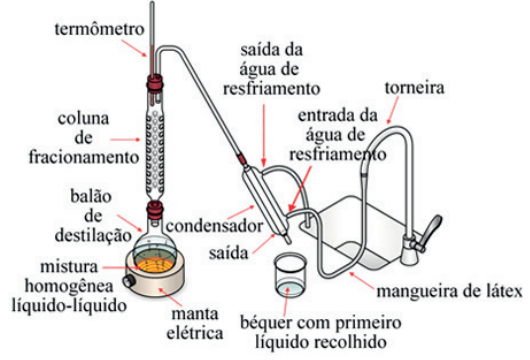
Em escala industrial, destacamos a Destilação Fracionada do Petróleo. Nela, a coluna de fracionamento apresenta diversas saídas. Cada saída se encontra conectada a tubulações de onde é possível se obter as frações do petróleo como gasolina, diesel, querosene etc.

(http://www.wikiwand.com)
(http://www.explicatorium.com)
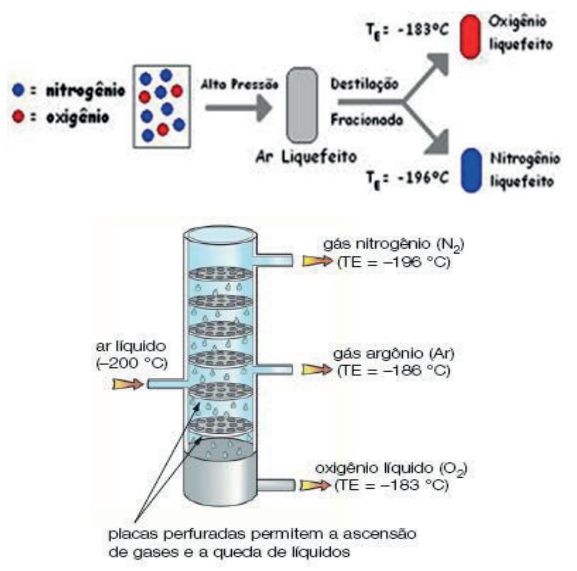
LIQUEFAÇÃO FRACIONADA
Processo de separação dos componentes (gás e gás) de uma mistura homogênea. Considere liquefazer a mistura e, a seguir, submetê-la a uma destilação fracionada, pois, assim, o de menor PE é destilado. Através desse processo, podemos, por exemplo, fazer a separação do nitrogênio e do oxigênio do ar. Colocamos a mistura (ar) num cilindro adequado e a submetemos a um aumento de pressão e a uma retirada de calor, até obtermos o ar liquefeito.
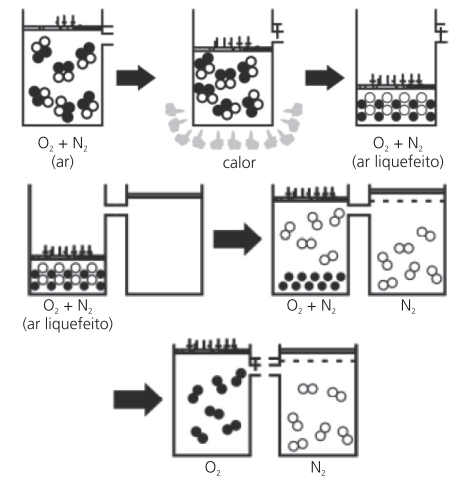
MISTURAS GASOSAS
Perguntas que costumamos fazer quando vamos visitar uma pessoa no hospital é: “Como o oxigênio usado para auxiliar a respiração de alguns pacientes chega ao seu leito, qual é a fonte de extração do mesmo e qual é o procedimento que permite o seu isolamento?”. Esse processo é muito parecido com a destilação fracionada e é denominado Liquefação Fracionada. A grande diferença entre os dois procedimentos é que na Liquefação Fracionada a mistura gasosa é condensada pela ação de uma grande pressão e um fortíssimo resfriamento. Em seguida, com a despressurização e aumento gradual de temperatura, os componentes vão passando do estado líquido para o estado gasoso de forma semelhante à destilação fracionada. Devemos destacar que a fonte de obtenção do gás oxigênio comentado anteriormente é o ar atmosférico, e que qualquer componente gasoso com oxigênio, nitrogênio, dióxido de carbono, argônio etc. é comercializado transportado no estado líquido em tambores submetidos à elevada pressão, e a chegada do mesmo, no estado gasoso, ao leito de um hospital, faz-se despressurizando esse tambor.
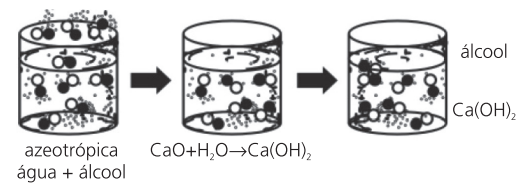
OBTENÇÃO DE MISTURA AZEOTRÓPICA – ÁGUA E ÁLCOOL (QUI003)
Para obtermos o álcool absoluto, o álcool puro, utilizamos processos químicos. Adicionamos à mistura azeotrópica água e álcool, por exemplo, óxido de cálcio (CaO), que reage com a água produzindo hidróxido de cálcio Ca(OH)2. A seguir, submetemos a mistura a uma destilação, pois agora somente o álcool destila, sendo, portanto, recolhido puro no béquer.
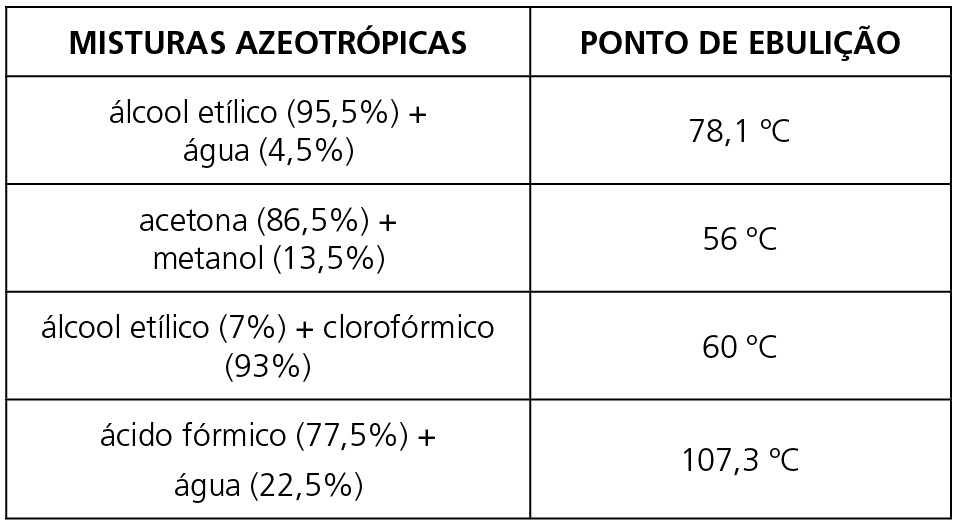
ALGUNS EXEMPLOS DE MISTURAS AZEOTRÓPICAS
A ÁGUA
A água pura (H2O) é um líquido encontrado na natureza e tem dissolvida entre as suas moléculas gases como oxigênio (O2), dióxido de carbono (CO2) e nitrogênio (N2). Também fazem parte desta solução líquida sais, como nitratos, cloretos e carbonatos. Algumas vezes outras substâncias químicas dissolvidas podem vir a dar gosto e cor a esta água podendo ocasionar uma reação, tornando a água alcalina ou ácida. Sua temperatura sofre variações de acordo com a profundidade e com o local onde é encontrada.
Subentende-se como água uma substância da natureza, um recurso renovável, encontrado em 3 estados físicos: sólido (gelo), líquido (água) e gasoso (vapor d’água), sendo que a água utilizada para o consumo humano e para as atividades socioeconômicas é retirada de rios, lagos, represas, aquíferos, também conhecidos como águas internas.