Avogadro por meio experimental determinou que:
É preciso juntar 6,02 · 1023 átomos de um elemento para que sua massa em unidades de massa atômica seja expressa em gramas. Além disso, é necessário juntar 6,02 · 1023 u para que a massa total seja de 1 g. Portanto, o número de Avogadro é o fator de conversão entre as duas unidades.
Logo:
1 mol ⇒ 6,02×1023 partículas
Assim sendo, por uma “contagem indireta”, foi denominada como constante de Avogadro.
Observação: Constante de Avogadro é o número de átomos (6,02 · 1023) existentes quando a massa atômica de um elemento é expressa em gramas.
Exemplos:
12u de C: massa de 1 átomo de C
12g de C: massa de 6,02 · 1023 átomos de C
27u de Aℓ: massa de 1 átomo de Aℓ
27g de Aℓ: massa de 6,02 · 1023 átomos de Aℓ
56u de Fe: massa de 1 átomo de Fe
56g de Fe: massa de 6,02 · 1023 átomos de Fe
Observação:
IMPORTÂNCIA DA CONSTANTE DE AVOGADRO
Conhecendo-se a constante de Avogadro e a massa atômica de um elemento, é possível calcular a massa em gramas de um único átomo. Por exemplo, para se calcular a massa, em gramas, de um átomo de Mg (MA = 24u; constante de Avogadro =6,02 · 1023), procedemos da seguinte forma:

Essa é a massa em gramas de um átomo de Mg.
O valor mais preciso da constante de Avogadro é 6,022045 ⋅ 1023. A expressão constante de Avogadro é uma homenagem ao italiano Lorenzo Amedeo Avogadro (1776-1856), que lançou as ideias básicas que conduziram a esse conceito.
Conhecendo-se a constante de Avogadro e a massa atômica de um elemento, é possível calcular o número de átomos numa massa conhecida de um elemento qualquer.
Exemplo Geral:
Vamos calcular o número de átomos existentes em 48 g de Mg.

Esse é o número de átomos em 48 g de Mg.
Exemplos:
01. Considerando 90 g de escândio (Sc=45 u):
a) Qual é o número de mols?
b) Qual é o número de átomos?
Resolução:

02. Em 80 g de metano, de fórmula molecular CH4, (C=12, H=1):
a) Qual é o número de moléculas?
b) Qual é o número de mols?
Resolução:

03. Vamos calcular o total de átomos contidos em 49 g de H2SO4 (MA H = 1u; MA S = 32u; MA O =16u).
Resolução:

Cálculo do número de átomos:

Esse é o número de átomos em 49 g.
Generalizando:
Constante de Avogadro (6,02 · 1023) é o número de espécies químicas (átomos, moléculas, fórmulas, íons etc.) existentes quando a massa atômica, a massa molecular e a massa-fórmula da espécie considerada são expressas em gramas.
04. Qual é a massa, em gramas, de 2,5 mols de ácido nítrico (HNO3)? Dados: H=1u; O=16u e N=14u
Resolução:
Inicialmente, calculamos a massa molar:
M∗ = 1 + 14 + 3 ⋅ 16 = 63 g/mol
Utilizando proporção, temos:

Utilizando fórmula matemática, temos:

05. Qual é a massa, em gramas, de uma só molécula de água? Dados: H = 1u; O = 16u e NA = 6 · 1023 partículas/mol.
Resolução:
Um mol de moléculas de água corresponde a 6,02 · 1023 moléculas e tem massa de 18 g (M*).

06. Quantos átomos existem em 36 g de H2O?
Resolução:
Seguindo o mesmo raciocínio do exemplo anterior, temos:
1 molécula de H2O = 18u
1 mol de moléculas de H2O = 6, 02 . 1023 moléculas de H2O = 18g . Portanto:

Mas o problema pergunta qual o número de átomos. Para isso, apliquemos a seguinte propriedade distributiva:
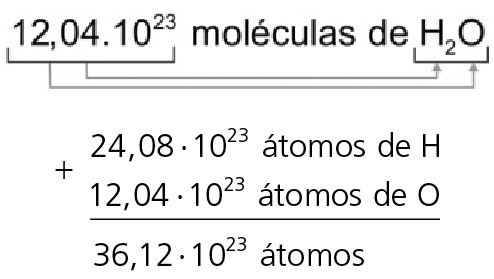
Portanto, em 36 g de H2O existem 36,12 · 1023 átomos.
Os elementos e as substâncias que se encontram nas fases sólida ou líquida possuem volume próprio, cuja variação em função da pressão ou da temperatura pode ser considerada desprezível.
Já os elementos e as substâncias que se encontram na fase gasosa não possuem volume próprio.
É uma característica do gás ocupar todo o volume do recipiente que o contém, e esse volume depende diretamente das condições de pressão e temperatura em que o gás se encontra.




