RAIO (OU TAMANHO) DOS ÁTOMOS
Exemplo:
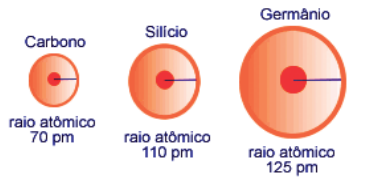
Raios Atômicos do Carbono, Silício e Germânio em picômetros (pm). (1 pm = 10-12 m)
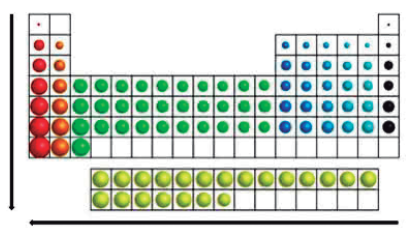
Crescimento do Raio Atômico ao longo da Classificação Periódica.
Considerações:
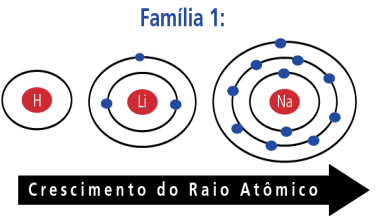
- O raio atômico aumenta com o aumento do número de camadas eletrônicas dos átomos.
- O raio atômico diminui como o aumento da carga nuclear do átomo devido ao aumento da força de atração exercida pelo núcleo para com os elétrons.
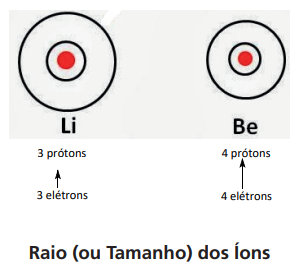
- Cátions: os cátions apresentam um raio menor do que os átomos que lhe deram origem.
- Ânions: os ânions apresentam um raio maior do que os átomos que lhe deram origem.
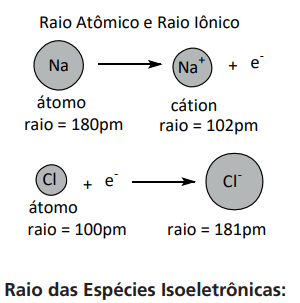
Nas espécies isoeletrônicas, quanto maior a carga nuclear (número de prótons) da espécie, menor será o valor do raio da mesma.
Exemplo:
%20dos%20átomos/tamanho%20dos%20átomos%20-%201.png)




