PROPRIEDADES GERAIS
São propriedades comuns a todo e qualquer tipo de matéria. Essas propriedades estão relacionadas com as Leis Fundamentais da Física Clássica como a inércia, impenetrabilidade, compressibilidade, elasticidade, porosidade, a massa, o volume etc.
PROPRIEDADES ESPECÍFICAS
São propriedades que podem, precisa ou imprecisamente, identificar o tipo de matéria que está sendo analisada. Podem ser divididas em: organolépticas, químicas e físicas.
PROPRIEDADES ORGANOLÉPTICAS: detectadas pelos sentidos humanos como a cor, o cheiro, o tato, o paladar.
PROPRIEDADES QUÍMICAS: relacionadas às transformações químicas que um determinado tipo de matéria pode sofrer.
Exemplo: oxidação, combustão.
PROPRIEDADES FÍSICAS: propriedade de uma substância que pode ser observada sem transformar uma substância em outra. É determinante no grau de pureza de uma amostra analisada.
Exemplo: densidade, temperatura de fusão e temperatura de ebulição.
PRINCIPAIS PROPRIEDADES FÍSICAS
DENSIDADE ABSOLUTA OU MASSA ESPECÍFICA (d)
densidade = massa/volume

Fonte: professorcidao.wordpress.com / http://www.cienciamao.usp.br
TEMPERATURA DE FUSÃO (TF) E TEMPERATURA DE EBULIÇÃO (TE)
Numa pressão constante, alguns materiais, quando aquecidos, podem entrar em fusão e/ou em ebulição num valor fixo de temperatura. Este fato serve para determinar o grau de pureza de uma determinada amostra.
Essas temperaturas podem ser alteradas com a mudança de pressão. Por exemplo, na altitude, a substância água apresenta temperaturas de fusão e ebulição inferiores a 0 °C e 100 °C, respectivamente, que são seus valores à nível do mar cuja pressão atmosférica é igual a 1 atmosfera (atm) ou 760 milímetro de mercúrio (mmHg). Essa análise pode ser melhor ilustrada através do diagrama de fases da substância.
Observação: DIFERENCIAÇÃO ENTRE EVAPORAÇÃO, EBULIÇÃO E CALEFAÇÃO
- Evaporação: é a mudança de fase do estado líquido para o gasoso de modo gradual, lento.
Exemplo: a roupa que seca no varal.
- Ebulição: a passagem do estado líquido para o gasoso é causada por um aumento na temperatura, por isso é mais rápida que a anterior.
Exemplo: água fervendo.
- Calefação: é uma vaporização muito mais rápida que as duas anteriores. Ocorre quando um líquido entra em contato com uma superfície que está com a temperatura mais elevada que seu ponto de ebulição.
Exemplo: Gotas de água “pulando” em contato com o ferro de passar ou com uma chapa de fritar alimentos.
TEMPERATURA CRÍTICA
É a temperatura acima da qual a substância pode existir somente na forma de gás. Acima dessa temperatura, um gás não pode ser liquefeito, por mais que a pressão do sistema seja elevada.
A substância água, em condições ambientes (pressão de 1 atm e temperatura de 25 ºC) é encontrada na natureza no estado líquido, quando ela se vaporiza, está abaixo da sua temperatura crítica; nessas condições, ela é considerada vapor. Por outro lado, a substância oxigênio já se encontra no estado gasoso nessas condições, e acima de sua temperatura crítica. Esse fato, nos leva a concluir que o oxigênio é considerado um gás.
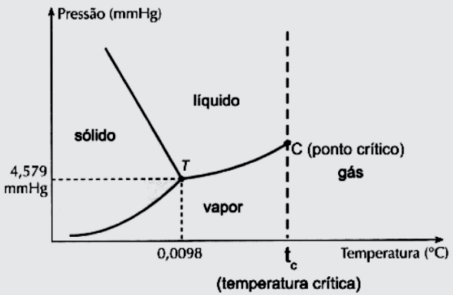
Fonte: https://manualdaquimica.uol.com.br
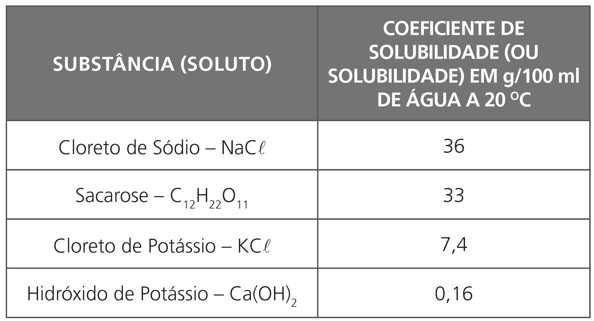
SOLUBILIDADE
Procura aferir, numa dada pressão e temperatura, a quantidade em uma amostra (soluto) que se dissolve numa quantidade fixa de outra substância padronizada (solvente). Os valores das solubilidades das substâncias em água, por exemplo, são tabelados, o que pode servir como critério de pureza.
TRANSFORMAÇÕES DA MATÉRIA: FENÔMENOS FÍSICOS E QUÍMICOS
As transformações da matéria são também chamadas de fenômenos materiais (ou simplesmente fenômenos), sendo que, nessa expressão, a palavra ”fenômeno” significa apenas transformação.
Denomina-se fenômeno físico todas as transformações que não alteram as propriedades físicas e químicas das substâncias.
Exemplo: qualquer mudança de fase de agregação.
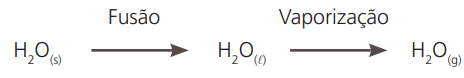
Mesmo mudando de fase de agregação, a água continua sendo incomburente (não provoca nem sofre combustão), continua com ponto de fusão 0 ºC e ponto de ebulição 100 ºC (ambos sob pressão de 1 atm) e densidade 1,0 g/cm3 (a 20 ºC e 1 atm).
Denomina-se fenômeno químico todas as transformações que alteram as propriedades físicas e químicas das substâncias.
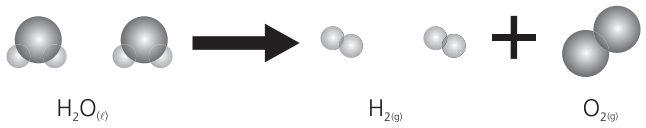
Exemplo: eletrólise da água.
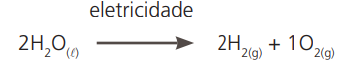
Na eletrólise, a água se transforma em gás hidrogênio e gás oxigênio, cujas propriedades são totalmente diferentes das suas. Considerando pressão de 1 atm e densidade medida a º20 ºC, temos:
- Gás hidrogênio: é combustível (sofre combustão), possui ponto de fusão –259,14 ºC, ponto de ebulição –252,7 ºC e densidade 0,0709/cm3.
- Gás oxigênio: é comburente (provoca combustão), possui ponto de fusão –218,4 °C, ponto de ebulição –183,0 ºC e densidade º1,14/cm3 (a 20 ºC e 1 atm).
Os fenômenos químicos são denominados reações e são representados por uma equação química. A equação química mostra claramente que a transformação de uma substância em outra é, na verdade, um reagrupamento de átomos. Algumas ligações químicas são rompidas e outras ligações químicas são formadas.
A formação de uma nova substância está associada à/ao:
a) Mudança de cor. Exemplos: queima de papel; água sanitária ou água de lavadeira em tecido colorido; queima de fogos de artifício.
b) Liberação de um gás (efervescência). Exemplos: antiácido estomacal em água; bicarbonato de sódio (fermento de bolo) em vinagre.
c) Formação de um sólido. Ao misturar dois sistemas líquidos ou um sistema líquido e um gás, poderá ocorrer a formação de uma nova substância sólida. Exemplos: líquido de bateria de automóvel + cal de pedreiro dissolvida em água; água de cal + ar expirado pelo pulmão (gás carbônico).
d) Aparecimento de chama ou luminosidade. Exemplos: álcool queimado; luz emitida pelos vaga-lumes.
Os átomos de um elemento químico jamais se transformam em átomos de outro elemento durante uma transformação química. Isto só ocorre em reações nucleares.
Observação: Atualmente, sabemos que algumas transformações são passageiras ou reversíveis, isto é, podem ser desfeitas. Transformações desse tipo recaem, em geral, no que chamamos de transformações físicas (ou fenômenos físicos). Exemplificando:
- em montanhas muito altas, a água se congela; mas, com um pouco de calor, a neve ou o gelo derretem facilmente, voltando à forma líquida;
- num termômetro, o mercúrio se dilata com o calor e se contrai com o frio, mas continua sendo sempre o mesmo mercúrio.
Outras transformações são mais profundas e frequentemente irreversíveis, isto é, torna-se difícil (e, às vezes, impossível) retornar à situação inicial. São, em geral, transformações, fenômenos ou reações químicas.




