Produto de solubilidade

Solução Saturada → Sistema em Equilíbrio

Constante do Produto de Solubilidade (Kps):

Quando misturamos duas soluções iônicas, a combinação entre o cátion de uma e o ânion da outra pode originar um produto insolúvel ou precipitado. Para que isso ocorra, é necessário que as concentrações na solução estejam num valor capaz de deslocar o equilíbrio iônico no sentido da precipitação.
Considere [Ay+]’ e [Bx-]’, as concentrações de Ay+ e Bx- obtidas após a mistura das soluções, supondo a não ocorrência da precipitação.
Se [Ay+]‘x · [Bx-]‘y < Kps → solução insaturada → precipitação impossível.
Se [Ay+]‘x · [Bx-]‘y= Kps → solução saturada → precipitação impossível.
Se [Ay+]‘x · [Bx-]‘y > Kps → solução Supersaturada → precipitação provável.
Relação entre o Kps e o Coeficiente de Solubilidade:

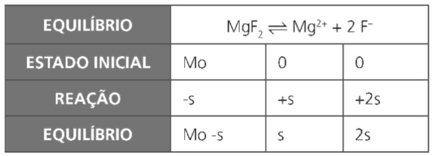
Exemplo 1: o Kps do Fluoreto de Magnésio (MgF2) é igual a 8×10–8.
a) Verifique a possibilidade de formação de precipitado após a mistura de 20 mL de solução 0,01 mol ⋅ L-1 de nitrato de magnésio, Mg(NO3)2 , com 80 mL de solução 0,05 mol ⋅ L-1 de fluoreto de sódio, NaF.
b) Qual é o valor do coeficiente de solubilidade, em mol ⋅ L-1, do fluoreto de magnésio?
c) Qual concentração de nitrato de magnésio é necessária para tornar saturada a solução apresentada de fluoreto de sódio?
Resolução:

b)

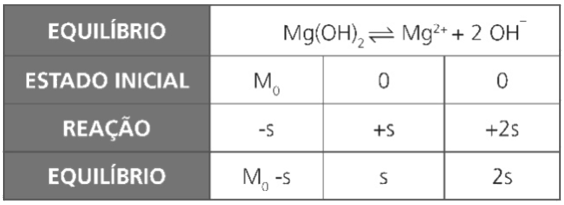
Exemplo 2: o Kps do Hidróxido de Magnésio, Mg(OH)2, é igual a 3,2 × 10–11. Determine o pH de uma solução saturada de hidróxido de magnésio. Dado: log2 = 0,3.
Resolução: