ENERGIA INTERNA (U)
É o conteúdo energético de um sistema, está relacionado ao somatório de todos os tipos de energia provocado pelos movimentos moleculares de translação, rotação e vibração, como também às interações intermoleculares existentes.

∆U→ Quando um sistema troca calor com suas vizinhanças, é intuitivo imaginar que as alterações que as moléculas sofrem em seus diversos tipos de movimento, como também suas interações intermoleculares, implica numa variação de sua energia interna. Logo:
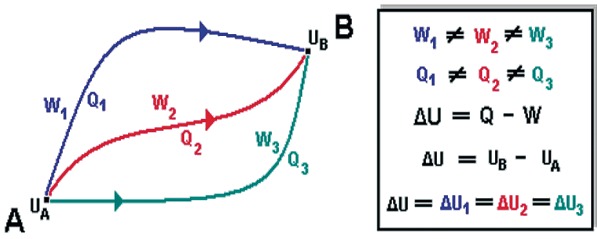
ΔU = U(final) − U(inicial) = U2 − U1
∆U > 0 → O sistema ganha energia na forma de calor → Processo Endergônico
∆U > 0 → O sistema perde energia na forma de calor → Processo Exergônico
Observação:
Essa condição define a Energia Interna como uma função de estado, assim como a pressão, volume e temperatura, pois a sua variação é independente da forma da (trajetória), como ocorre com o trabalho. Sendo assim a Energia Interna é considerada como “função de ponto” e sua variação depende exclusivamente de sues estados final e inicial, enquanto o trabalho é definido como uma “função de linha” que depende do caminho realizado entre os estados final e inicial.
O estado inicial de uma função de estado deve servir de referência para a medida da sua variação. É comum definir esse estado dentro de uma condição de padrão. Em situações que não dependem do estado de agregação do material analisado no sistema, adotamos como condição padrão a pressão de 1 atm e a temperatura de 298 K(25º C).
PRIMEIRO PRINCÍPIO DA TERMODINÂMICA
Observações Importantes:
I. A Termodinâmica estuda sistemas de muitas partículas, sendo assim as diferenças e relações entre calor e trabalho só fazem sentido para situações macroscópicas.
II. É impossível a conversão integral de calor em trabalho. Esse fato pode ser explicado pela transferência de calor com realização de trabalho.
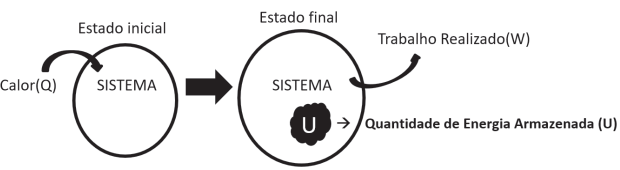
No esquema, o conteúdo calorífico fica armazenado no sistema. Ele será responsável pelos diversos tipos de movimentos das partículas presentes no mesmo, como também pelas interações intermoleculares. Sendo assim podemos concluir que esse conteúdo é a energia interna (U) do sistema.
Q = U + W
U = Q – W
Observação:
U = Q2 = Qv
TRABALHO EM TRANSFORMAÇÃO ADIABÁTICA
São processos termodinâmicos nos quais não ocorrem transferências de calor entre um sistema e suas vizinhanças.
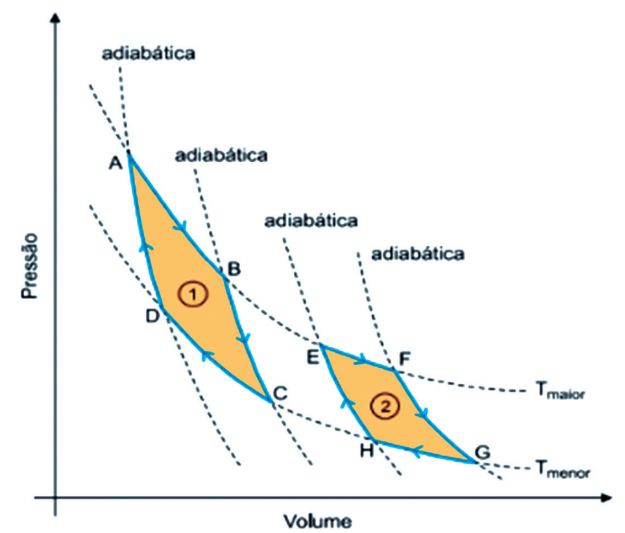
Se Q = 0 → W = – ΔU




