ÓXIDOS
Óxido básico + água → base
Exemplo: CaO(s) + H2O(ℓ) → Ca(OH)2 (aq)
Óxido ácido + água → ácido (oxiácido)
Exemplo: SO3(g) + H2O(ℓ) → H2SO4(ℓ)
Observação: nomenclatura de oxiácidos baseada em diferentes graus de hidratação.
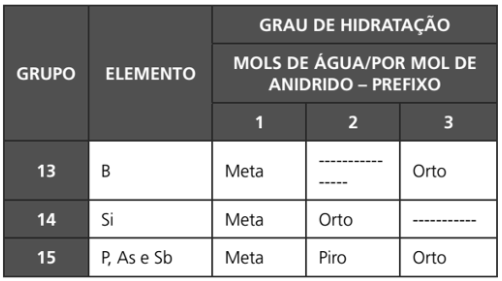
Exemplos:
H3AsO4 – ácido ortoarsênico
HBO2 – ácido metabórico
H4P2O5 – ácido pirofosforoso
Observação: oxiácidos formados pela reação de dois mols de moléculas do anidrido com um mol de água.
H2Cr2O7 – ácido dicrômico: 2 CrO3 + H2O → H2Cr2O7
H4 B2O7 – ácido tetrabórico: 2 B2O3 + H2O → H4 B2O7
a) Óxido ácido + base → sal + água
Exemplo: SO3( g) + 2NaOH(aq) → Na2SO4(aq) + H2O(ℓ)
b) Óxido básico + base → sal + água
Exemplo: CaO(s) + 2HC𝓁(aq) → CaC𝓁2(aq) + H2O(ℓ)
c) Óxido ácido + óxido básico → sal
Exemplo: SO3(g)+CaO(s)→CaSO4(s)
d) Óxido Anfótero + ácido → sal1 + água
Exemplo: A𝓁2O3( s) + 6HC𝓁(aq) → 2AlCℓ3(aq) + 3H2O(ℓ)
e) Óxido Anfótero + ácido → sal2 + água
Exemplo: A𝓁2O3(s) + NaOH(aq) → NaA𝓁O2(aq) + H2O(ℓ)
f) Óxidos Neutros – não reagem com água, ácidos ou bases.
g) Óxido Duplo Metálico + ácido → sal (oso) + sal (ico) + água
Exemplo: Fe3O4( s) + 8HC𝓁(aq) → 2FeC𝓁2(aq) + 3FeC𝓁3(aq) + 4H2O(0)
h) Óxido Duplo Ametálico + água → ácido(oso) + ácido(ico)
Exemplo: 2NO2(g) + H2O(ℓ) → HNO2(aq) + HNO3(aq)
i) Óxido Duplo Ametálico +base → sal(ito) + sal(ato) + água
Exemplo: NO2(g) + NaOH(aq) → NaNO2 (aq) + NaNO3(aq) + H2O(ℓ)
j) Peróxido + ácido → sal + peróxido de hidrogênio
Exemplo: Na2O2( s) + 2HC𝓁 → 2NaC𝓁(aq) + H2O2(ℓ)
k) Polióxido + ácido → sal + peróxido de hidrogênio + oxigênio
Exemplo: 2KO2(s) + 2HC𝓁 → 2KC𝓁(aq) + H2O2(ℓ) + O2(g)
ÁCIDOS
Ácido forte + Sal (de ácido fraco) → Ácido fraco + Sal (de ácido forte)
Exemplo: 2HC𝓁(aq) + Na2S(s) → H2 S(g) + 2NaC𝓁(aq)
Observação: essas reações geralmente produzem um ácido fraco volátil. Quando o ácido carbônico (H2CO3) é produzido nesse tipo de reação, ele sofre decomposição produzindo dióxido de carbono (CO2) e água. De forma análoga, o ácido sulfuroso produz dióxido de enxofre (SO2) e água.
BASES
Base forte + Sal (de base fraca) → Base fraca + Sal (de ácido forte)
Exemplo: 3NaOH(aq) + FeC𝓁3(aq) → Fe(OH)3( s) + 3NaC𝓁(aq)
Observação: essas reações geralmente produzem uma base fraca insolúvel. Quando o hidróxido de amônio (NH4OH) é o produto desse tipo de reação, ele sofre decomposição se transformando em amônia (NH3) e água.
SAL
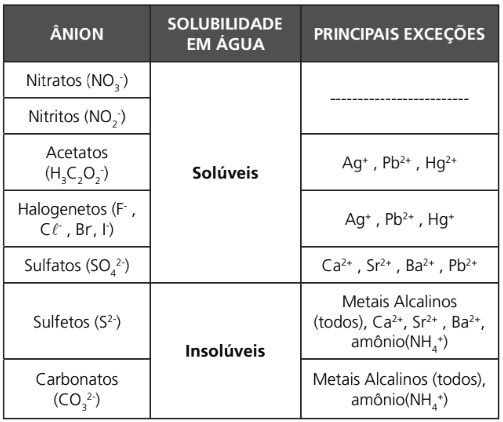
Sal solúvel (1) + Sal solúvel (2) → Sal solúvel (3) + Sal insolúvel
Exemplo: Na2SO4(aq) + BaC𝓁2(aq) → 2NaC𝓁(aq) + BaSO4( s)
TABELA DE SOLUBILIDADE EM ÁGUA DOS PRINCIPAIS SAIS
REAÇÕES DE METAIS DESLOCANDO O HIDROGÊNIO DA ÁGUA E DOS ÁCIDOS
Metal Alcalino + H2O → Base + H2 (reação explosiva)
Exemplo: 2Na(s) + 2H2O(ℓ) → 2NaOH(aq) + H2( g)
Metal + Ácido → Sal + H2
Esse tipo de reação pode ocorrer entre um metal mais reativo do que o hidrogênio (metal alcalino, metal alcalino-terroso, alumínio, zinco e ferro).
Exemplos:
2 Aℓ(s) + 6HCℓ(aq) → 2 AlCℓ3(aq) + 3H2( g)
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2( g)
O ferro é um metal que reage dessa forma com ácidos, como o clorídrico em solução concentrada, produzindo o cloreto ferroso e hidrogênio.
Fe(s) + 2HC𝓁(concentrado) → FeC𝓁2(aq) + H2( g)
Os metais nobres, menos reativos do que o hidrogênio, não são capazes de deslocar o hidrogênio dos ácidos.
Os metais nobres como cobre e a prata, quando em presença de ácido sulfúrico concentrado ou ácido nítrico, diluído ou concentrado, promovem uma reação em que o ânion sulfato do ácido sulfúrico funciona como agente oxidante, produzindo o sulfato do metal de maior número de oxidação, dióxido de enxofre e água e o ânion nitrato do ácido nítrico, também atua como agente oxidante, produzindo nitrato do metal de maior número de oxidação, monóxido de nitrogênio, o diluído, dióxido de nitrogênio, o concentrado e água.
Exemplos:

PRINCIPAIS REAÇÕES DE DECOMPOSIÇÕES TÉRMICAS
DECOMPOSIÇÃO DE CARBONATOS

Os carbonatos dos metais alcalinos não sofrem decomposição térmica.
DECOMPOSIÇÃO DOS BICARBONATOS

DECOMPOSIÇÃO DE HALOGENATOS (CLORATOS, BROMATOS E IODATOS)





