- Pilhas: envolve conversão de energia química em elétrica, e é um processo espontâneo.
- Eletrólise: envolve conversão de energia elétrica em energia química, e é um processo não espontâneo.
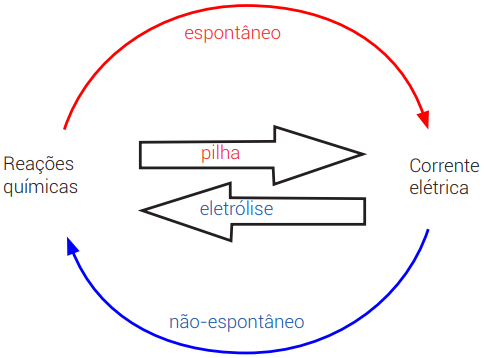
Podemos dividir o estudo da eletroquímica em dois grandes blocos:
Tais reações se baseiam na transferência de elétrons e são reações de oxirredução.
- OXIDAÇÃO→É a perda de elétrons, que acarreta em um aumento do nox do elemento.
- REDUÇÃO→É o ganho de elétrons, que acarreta em uma diminuição do nox do elemento.
Como os fenômenos da oxidação e da redução são sempre simultâneos, ou seja, um elemento perde elétrons para que um outro elemento os receba, é denominado agente oxidante a substância que contém aquele elemento que se reduz (provocando a oxidação em outro elemento), e agente redutor a substância que contém aquele elemento que se oxida (provocando a redução em outro elemento).
PILHAS E BATERIAS
As pilhas são dispositivos capazes de aproveitar a transferência de elétrons verificadas nas reações de oxirredução, convertendo em corrente elétrica capaz de alimentar um determinado circuito.
Temos uma bateria quando reunimos duas ou mais pilhas geralmente ligadas em série para aumentar a diferença de potencial (voltagem).
ELETRODO
É também conhecido como meia-célula eletroquímica. É o menor dispositivo que permite um funcionamento de uma pilha, consiste numa pequena placa metálica mergulhada numa solução salina. Exemplo: ELETRODO DE HIDROGÊNIO
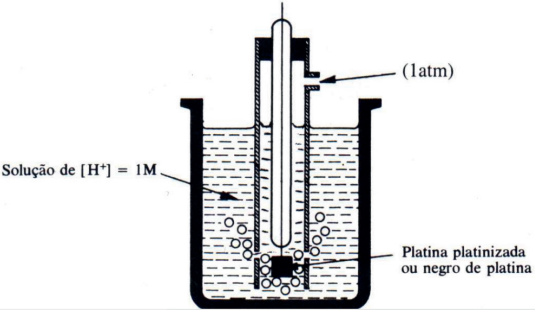
ELEMENTOS DE UMA PILHA
ANODO OU ÂNODO (POLO NEGATIVO) – Eletrodo pelo qual se verifica o fenômeno de oxidação. Após o funcionamento da pilha, observa-se uma corrosão da placa metálica e um aumento da concentração catiônica da solução.
CATODO OU CÁTODO (POLO POSITIVO) – Eletrodo pelo qual se verifica o fenômeno de redução. Após o funcionamento da pilha, observa-se um aumento da massa da placa metálica e uma redução da concentração catiônica da solução.
PONTE SALINA – Nela, os íons se deslocam para reequilibrar as concentrações das espécies. O catodo recebe cátions para compensar a perda catiônica provocada pelo fenômeno de redução e o anodo recebe ânions para neutralizar o excesso de cátions produzidos pelo fenômeno de oxidação.
DIFERENÇA DE POTENCIAL DE ELETRODOS APLICADA A UMA REAÇÃO REDOX – Os fenômenos eletroquímicos ocorrem devido às reações de oxirredução. Para se estudar a espontaneidade dessas reações e suas aplicações, é necessário o conhecimento dos potenciais de eletrodo (E) e da diferença de potencial deles (∆E).
Para uma reação de oxirredução, temos:
ΔE = E(sofre redução) – E(sofre oxidação)
ΔE > 0→Reação Espontânea → Produz Energia → Pilha em funcionamento, reações de oxirredução em geral.
ΔE=0→Reação em Equilíbrio → Pilha Descarregada
ΔE< 0 → Reação Não Espontânea → Só ocorrem com consumo de energia de uma fonte externa → Pilha em recarga, eletrólise.
A PILHA DE DANIELL
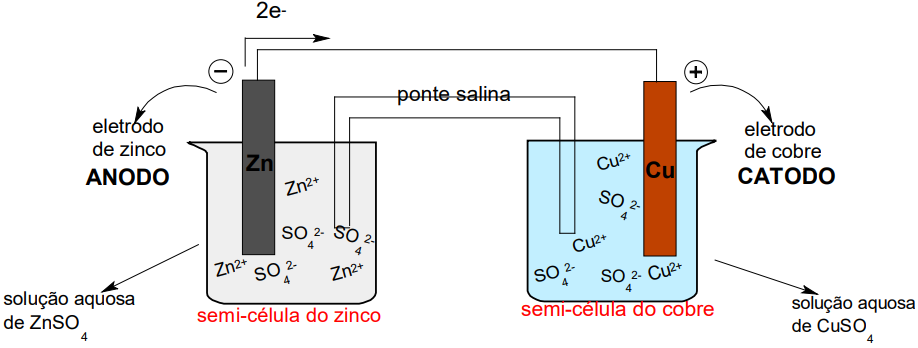
→Na semi-célula do zinco
O Zn0(s) do eletrodo oxida e perde dois elétrons:

Sendo assim, observa-se o consumo de Zn0(s), por meio do desgaste da placa de zinco. O Zn2+(aq) produzido na oxidação, está na solução aquosa (circuito interno) e irá para a semi-célula do cobre pela ponte salina.
Os dois elétrons perdidos na oxidação irão em direção a semicélula do cobre pelo fio condutor (circuito externo).
→Na semi-célula do cobre
O Cu2+(aq) recebe os dois elétrons que chegam pelo circuito externo e se reduz:

O encontro dos íons Cu2+(aq) da solução com os dois elétrons vindos da semi-célula do zinco, pelo fio condutor, ocorre na superfície da placa de cobre. Observa-se então a formação de Cu0(s) por meio do depósito sólido ocorrido sobre a placa de cobre.
Com o consumo de íons Cu2+(aq) na redução, os ânions SO2-4 (aq), em maior proporção, vão em direção a semi-célula do zinco através da ponte salina.
A PONTE SALINA
É um tubo de vidro em forma de U, contendo uma solução aquosa concentrada de um sal muito solúvel em água, normalmente KC𝓁(aq) ou NH4NO3(aq). Nas extremidades estão presentes pedaços de algodão (material poroso).
A função da ponte salina é permitir a migração de íons da solução de uma semi-célula para a outra, de modo que as cargas positivas e negativas em cada semi-célula permaneçam em equilíbrio.
Na semi-célula do zinco, com a oxidação do Zn0(s) para Zn2+(aq), a concentração de cátions na solução se torna maior que a de ânions.
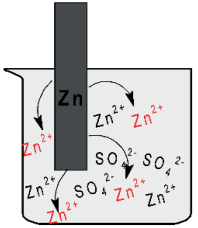
Por isso, os íons Zn2+(aq) migram pela ponte salina em direção à semi-célula do cobre. Sendo assim, os cátions migram em direção ao catodo. Na semi-célula do cobre, com a redução do Cu2+(aq) para Cu0(s), a concentração de ânions se torna maior que a de cátions.
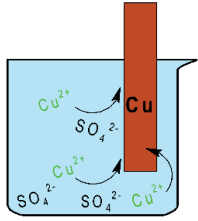
Por isso os íons SO2-4 (aq) migram pela ponte salina em direção à semi-célula do zinco. Sendo assim, ânions migram em direção ao anodo.
De modo geral, pode-se dizer que nas pilhas os polos podem ser determinados através da movimentação dos elétrons no circuito externo. Assim, o elétron vai sempre em direção ao polo oposto à sua carga (+). Em resumo, os elétrons saem sempre do anodo (polo negativo) em direção ao catodo (polo positivo).




