INTRODUÇÃO
Temos, por exemplo, na formação de uma ligação iônica, que um dos átomos cede elétrons para o outro que ganha efetivamente estes elétrons, veja:

O sódio sofreu um aumento do seu NOX, logo sofreu oxidação (perda de elétrons), e o cloro sofreu uma diminuição do seu NOX, logo sofreu redução (ganho de elétrons). Evidentemente, os fenômenos de oxidação e redução sempre ocorrem de forma simultânea e vão constituir o que podemos chamar de reação de oxirredução.
OXIDAÇÃO E REDUÇÃO (OXIRREDUÇÃO)
Oxidação é toda transformação na qual há aumento do número de oxidação de uma espécie química pela perda de elétrons.
Redução é toda transformação na qual há diminuição do número de oxidação de uma espécie química pelo ganho de elétrons.
Exemplo:
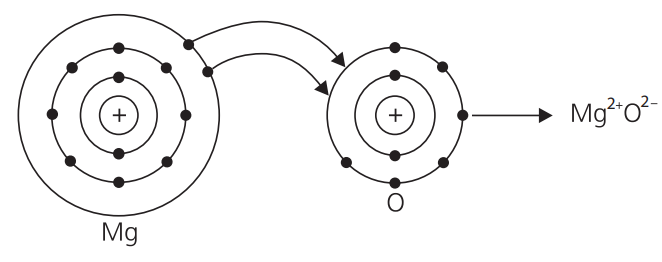
O magnésio, que perdeu 2 elétrons, sofreu oxidação. Diz-se que o oxigênio sofreu redução porque ganhou 2 elétrons.
Observe o que acontece com o número de oxidação do oxigênio:
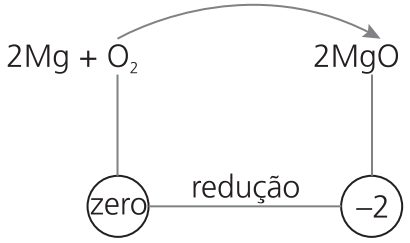
O número de oxidação do oxigênio, que recebeu 2 elétrons, diminuiu, passando de zero para -2.
Observação:
A palavra “oxidação” deriva do fenômeno químico “combinar com o oxigênio”. Assim, a espécie que se combina com o oxigênio sofre oxidação.
O que acontece com o átomo que se combina com o oxigênio?
Com exceção do flúor, todos os átomos, ao se combinarem com o oxigênio, perdem elétrons.
Assim, o fenômeno da oxidação pode ser traduzido como perda de elétrons.
Ocorre que, entre outros átomos, sem envolver o oxigênio, pode ocorrer esse fenômeno. Assim, o carbono do metano, ao se ligar a átomos de cloro, vai perdendo elétrons e sofrendo, portanto, oxidação.
Exemplo:
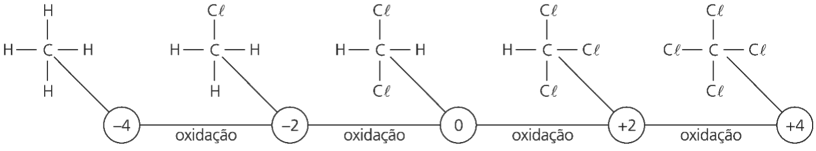
Assim, dizemos, resumidamente, que:
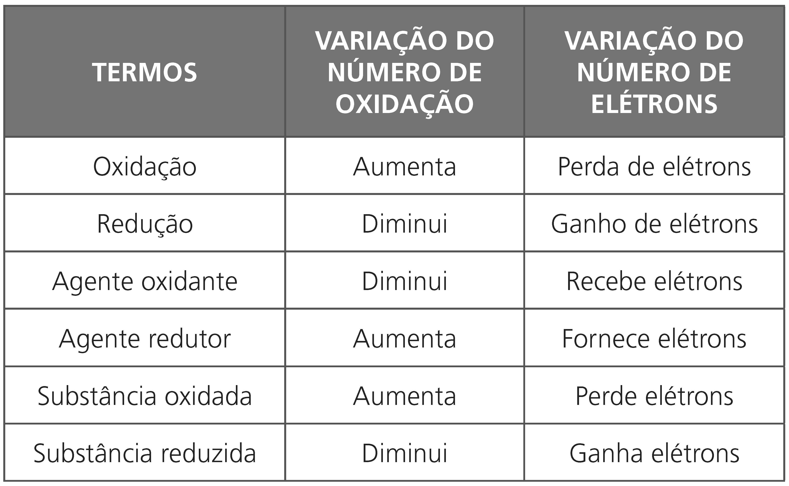
- OXIDAÇÃO é a perda de elétrons.
- REDUÇÃO é o ganho de elétrons.
- REAÇÃO DE OXIRREDUÇÃO é quando há transferência de elétrons.
OXIDANTES E REDUTORES
Agente oxidante ou Oxidante é a espécie química que faz acontecer oxidação em outra espécie.
Agente redutor ou Redutor é a espécie química que faz acontecer redução em outra espécie.
O oxidante, ao fazer uma espécie química sofrer oxidação, recebe elétrons desta e sofre redução.
O redutor, ao fazer uma espécie química sofrer redução, cede elétrons e sofre oxidação.
Pode-se dizer que:
OXIDANTE – contém átomo que sofre redução.
REDUTOR – contém átomo que sofre oxidação.
Na reação entre magnésio e oxigênio, o primeiro é redutor, pois sofre oxidação. O oxigênio é o oxidante, pois sofre redução.
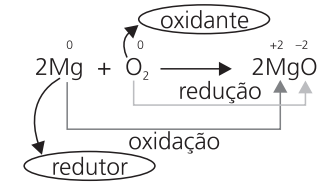
De uma forma geral, baseado no exemplo repetido abaixo, podemos dizer que:
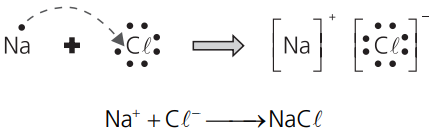
No exemplo dado Na+Cℓ−→ NaCℓ, a oxidação do sódio foi provocada pelo cloro – por isso chamamos o cloro de agente oxidante ou simplesmente oxidante –, e a redução do cloro foi causada pelo sódio – que é denominado agente redutor ou simplesmente redutor.
Os conceitos de oxidante e redutor não são exclusivos dos elementos químicos. Esses conceitos podem ser estendidos às substâncias cujos átomos recebem ou cedem elétrons. Por exemplo, na reação:
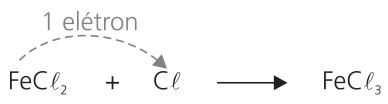
O FeCℓ2 é também chamado redutor, pois esse composto encerra um átomo de ferro, que irá ceder um elétron para o cloro.
RESUMO GERAL
Observações Complementares
Em muitos processos químicos, ocorre por parte de alguns átomos perda ou ganho de elétrons, dado a este fenômeno, o NOX pode aumentar ou diminuir ao longo do processo.
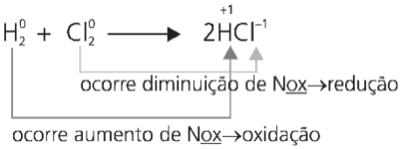
OXIDAÇÃO ⇒ ocorre quando uma espécie química perde elétrons ⇒ ocorre um aumento de NOX.
REDUÇÃO ⇒ ocorre quando uma espécie química ganha elétrons ⇒ ocorre uma diminuição de NOX.




