NÚMERO DE OXIDAÇÃO (NOX)
É uma carga elétrica aparente que o átomo de um elemento químico apresenta quando realiza uma ligação química.
Observação:
- Nos compostos iônicos, o nox dos elementos participantes é igual à carga dos respectivos íons.
Exemplo:
Cloreto de Sódio: o cloreto de sódio é um composto iônico formado pelo cátion sódio e o ânion cloreto conforme o esquema abaixo:
[Na+][C𝓁–]
Desta forma, o nox do sódio é +1 ou 1+ e o do cloro é -1 ou 1-.
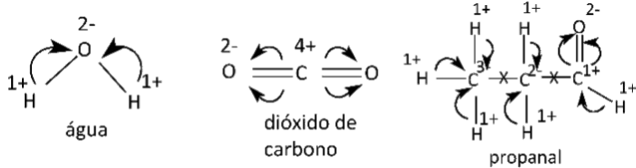
- Em compostos em cuja estrutura verificamos apenas ligações covalentes simples, devemos levar em conta as eletronegatividades dos átomos dos elementos participantes. Para cada ligação, atribuímos nox igual a 1- para o mais eletronegativo e nox igual a 1+ para o menos eletronegativo.
Exemplo:
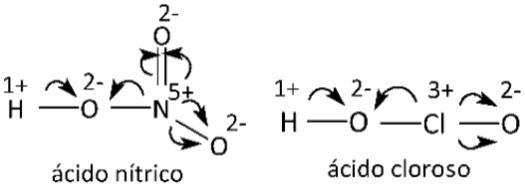
- Em compostos em cuja estrutura verificamos ligações covalentes coordenadas, também devemos levar em conta as eletronegatividades dos átomos dos elementos participantes. Para cada ligação, atribuímos nox igual a 2- para o mais eletronegativo e nox igual a 2+ para o menos eletronegativo.
Exemplo:
REGRAS BÁSICAS PARA A DETERMINAÇÃO DOS NÚMEROS DE OXIDAÇÃO
- Todos os metais alcalinos apresentam nox igual a 1+
- O hidrogênio apresenta nox igual a 1+ na maioria dos seus compostos. Porém, nos compostos binários com metais, hidretos metálicos, ele apresenta nox igual a 1-.
- O metal prata (Ag) apresenta nox igual a 1+ na grande maioria de seus compostos.
- Todos os metais alcalino-terrosos apresentam nox igual a 2+.
- Os metais zinco (Zn) e cádmio (Cd) apresentam nox igual a 2+ na maioria de seus compostos.
- O metal Alumínio (A) apresenta nox igual a 3+ na maioria de seus compostos.
- O flúor apresenta nox igual a 1- em qualquer de seus compostos
- Os demais halogênios, quando em compostos binários em que o outro elemento é menos eletronegativo, apresenta nox igual a 1-.
- Os demais halogênios, quando combinados com elementos que apresentam uma maior eletronegatividade, fluoretos e compostos nitrogenados e oxigenados, apresentam nox de valor positivo. Geralmente, esses valores são iguais a 1+, 3+, 5+ e 7+.
- O Oxigênio pode apresentar os seguintes valores de nox:
- Nos Fluoretos, compostos binários com o flúor, valores positivos iguais a 1+ e 2+.
- Nos óxidos normais, compostos binários de fórmula geral E2Ox, nox igual a 2-.
- Nos peróxidos, compostos binários de fórmula geral E2O2, nox médio igual a 1-.
- Nos superóxidos ou polióxidos, compostos binários de fórmula geral EO2, nox médio igual a 1/2-.
Observação: E é um elemento químico participante da substância. No caso dos peróxidos, geralmente, E é o hidrogênio ou um metal alcalino, e nos superóxidos E é um metal alcalino ou metal alcalinoterroso.
- Na maioria dos compostos ternários, quaternários etc., nox igual a 2-.
- Nas substâncias simples elementares, o nox do único elemento apresentado é sempre igual a ZERO.
- Nas substâncias compostas, o somatório do nox total dos elementos químicos participantes é sempre igual a ZERO.
- Nas espécies iônicas elementares ou compostas, o somatório do nox total dos elementos químicos participantes é sempre igual à carga elétrica apresentada pela espécie.
Alguns metais que apresentam nox variável:
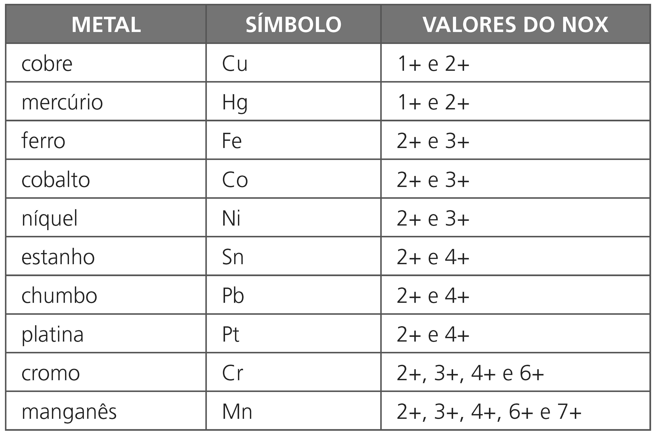
Exercício Resolvido:
01. Determine o número de oxidação dos elementos sublinhados:

Resolução:

02. Considere a estrutura plana da molécula do ácido lático:
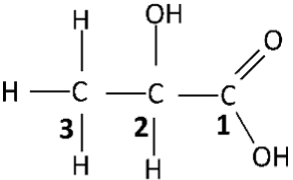
a) Determine o número de oxidação dos átomos de carbono indicados pelos números 1, 2 e 3.
b) Determine o número de oxidação do elemento carbono no ácido lático.
Resolução:





