TEORIA ATÔMICA DE DALTON
Segundo o modelo de Dalton, também conhecido como modelo da bola de bilhar, o átomo é uma partícula maciça e indivisível. O conjunto de afirmações feitas por ele sobre o átomo eram, basicamente, estas:
- Toda matéria é formada por partículas extremamente pequenas, os átomos.
- Os átomos são indivisíveis.
- Os átomos de um mesmo elemento são todos iguais, de mesma massa e com as mesmas propriedades.
- O número de átomos diferentes que existem na natureza é relativamente pequeno. Átomos de elementos diferentes são diferentes e têm massas diferentes.
- A formação dos materiais se dá através de diferentes associações entre átomos iguais ou não. Tais associações são os átomos compostos.
- Os átomos são indestrutíveis, sendo as reações químicas uma união ou separação de átomos.
- Em uma combinação química, os átomos unem-se em várias proporções, mas conservam suas massas.

A grande diferença entre o modelo atômico de Dalton e o dos filósofos da Antiguidade é que o primeiro foi criado com base em resultados experimentais, portanto foi um modelo científico. Ao contrário, o modelo dos filósofos da Antiguidade era fundamentado unicamente em pensamento filosófico, sem nenhuma base experimental.
O modelo do átomo como partícula indivisível vigorou durante praticamente todo o século XIX.
TEORIA ATÔMICA DE THOMSON
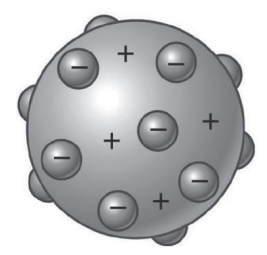
Alguns anos mais tarde, em 1904, Joseph John Thomson (1856- 1940) formulou uma teoria sobre a estrutura atômica da matéria. Segundo essa teoria, o átomo seria uma esfera positiva que, para tornar-se neutra, apresentava elétrons (partículas negativas) incrustados na sua superfície. Esse modelo de átomo ficou conhecido como plum-pudding (pudim de ameixas).
Modelo atômico de Thomson
POSTULADOS DE THOMSON – SENDO OS RAIOS CATÓDICOS UM FLUXO DE ELÉTRONS
- Os elétrons se propagam em linha reta.
- Os elétrons possuem massa (são corpusculares).
- Os elétrons possuem carga elétrica negativa (de natureza).
Observação: Num tubo de vidro denominado de Ampola de Crookes, são colocados dois eletrodos: o cátodo (polo negativo) e o ânodo (polo positivo).
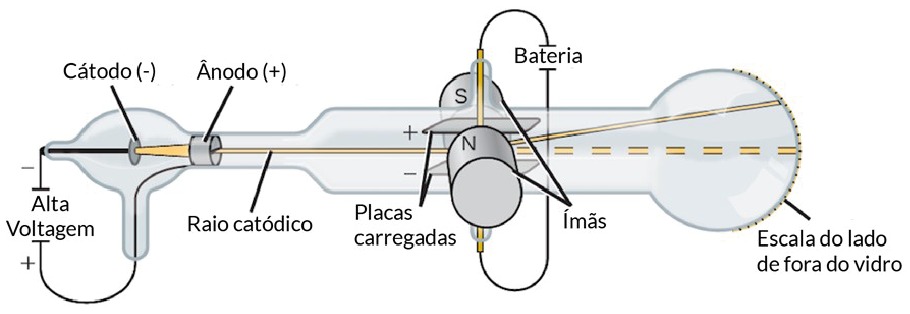
No interior do tubo existe gás rarefeito submetido a uma descarga elétrica superior a 10.000 volts. Do cátodo parte um fluxo de elétrons denominado raios catódicos, que se dirige à parede oposta do tubo, produzindo uma fluorescência decorrente do choque dos elétrons que partiram do cátodo com os átomos do vidro da ampola.
TEORIA ATÔMICA DE RUTHERFORD
Em 1911, Ernest Rutherford (1871-1937) realizou um experimento no qual uma lâmina de ouro foi bombardeada por partículas alfa provenientes do elemento polônio (Po), protegido por um bloco de chumbo.
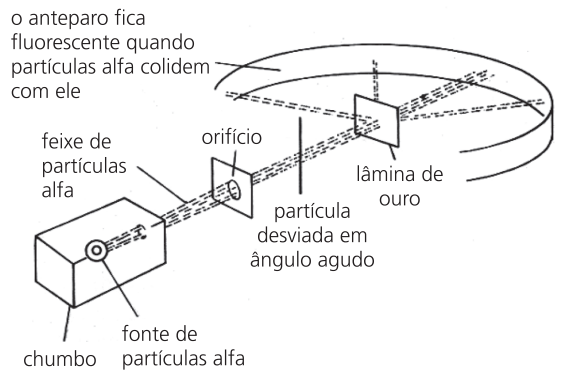
Rutherford constatou que:
- a maioria das partículas alfa atravessava livremente a lâmina de ouro;
- poucas partículas alfa passavam e sofriam desvio;
- poucas partículas alfa não atravessavam a lâmina de ouro.
Os resultados da experiência mostravam que a lâmina de ouro funcionava como uma peneira, isto é, a massa estaria distribuída de maneira não uniforme.
Rutherford chega a conclusões que o levam a arquitetar um novo modelo atômico: o átomo nuclear.
Rutherford concluiu que a massa da lâmina de ouro estaria distribuída em pequenos pontos, que ele chamou de núcleos.
Os desvios das partículas alfa, que são positivas, foram explicados admitindo que o núcleo é positivo e, portanto, formado por prótons. As partículas que não atravessavam a lâmina teriam colidido frontalmente com tais núcleos.
Como o átomo é neutro, o núcleo positivo estaria cercado pelos elétrons em uma região negativa, que foi denominada eletrosfera.
OBSERVAÇÃO: O MODELO EM SI
A experiência da “folha de ouro” foi o marco decisivo no aparecimento de um novo modelo atômico, que explicava melhor uma série de fatos observados.
O átomo deve ser constituído por duas regiões:
a) um núcleo, pequeno, positivo e possuidor de praticamente toda a massa do átomo;
b) uma região negativa, praticamente sem massa, que envolveria o núcleo. A essa região se deu o nome eletrosfera.
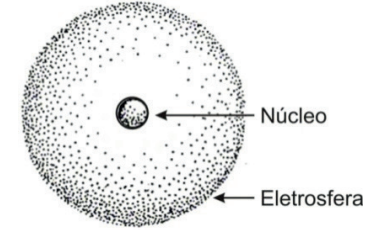
A ideia de um núcleo pequeno justifica o grande número de partículas que atravessam a folha de ouro sem sofrer desvio.
Além de pequeno, o núcleo deve ser positivo, o que justifica as poucas partículas α (positivas) que se desviam. Esses desvios ocorrem por repulsão entre a partícula α e o núcleo, ambos com cargas elétricas de mesmo sinal. A análise dos ângulos deu preciosas informações que foram posteriormente usadas em várias determinações desse mesmo núcleo.
Esse modelo de átomo nucleado justifica também as poucas partículas que não atravessam a folha de ouro e voltam impedidas pela grande massa concentrada (o núcleo).
Com a experiência de Rutherford, ficou demonstrado que o átomo é constituído em grande parte pelo vazio; ele é descontínuo. Um pequeno núcleo que concentra praticamente toda a massa e uma grande eletrosfera muito difusa e praticamente sem massa.
Temos aí, numa rápida abordagem, o que é um modelo, o que é uma experiência e que significado eles têm para a ciência.
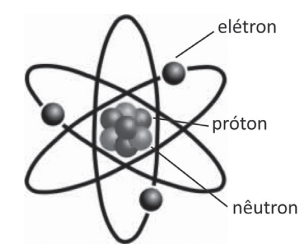
Rutherford supôs que os elétrons estariam dispostos ao redor do núcleo tal como os planetas ao redor do Sol. Em suas experiências, Rutherford observou que a massa do núcleo era muito maior que a sua carga. Disso, ele concluiu que no núcleo deveriam existir partículas sem carga elétrica e de massa quase igual a do próton.
Em 1932, James Chadwick provou a existência de tais partículas e deu a elas o nome de nêutrons. Com isso, o modelo atômico de Rutherford sofreu uma modificação, com a inclusão dos nêutrons juntamente com os prótons no núcleo.
Modelo atômico de Rutherford
NOTA COMPLEMENTAR:
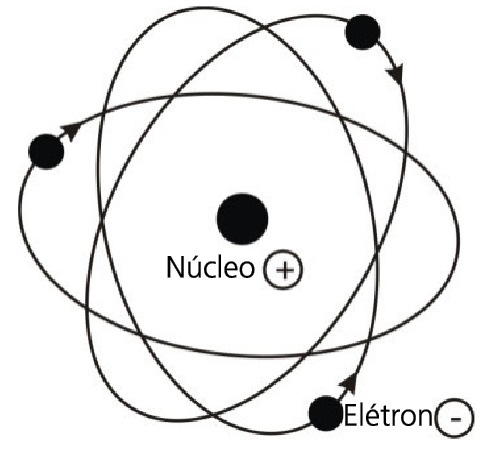
Em 1911, Ernest Rutherford, baseando-se na célebre experiência do espalhamento de partículas alfa por uma fina lâmina de ouro, propôs um modelo planetário para o átomo. Este modelo foi combatido na época, pois a Física sabia que uma partícula carregada, quando em movimento acelerado, libera energia.
O elétron, sendo uma partícula com carga negativa girando ao redor do núcleo, deveria perder energia e acabaria por colidir com o núcleo, destruindo a matéria.
A questão foi resolvida por Niels Bohr, então com 28 anos. Esse físico dinamarquês propôs um modelo atômico em que aplicava conceitos da Teoria Quântica, mostrando que a Mecânica de Newton não era conveniente para o estudo do comportamento de elétrons.
TEORIA ATÔMICA DE BOHR
O cientista dinamarquês Bohr (1885 – 1962) elaborou, em 1913, uma nova teoria sobre a distribuição e o movimento dos elétrons. A teoria de Bohr parte do modelo atômico de Rutherford, que afirma a existência de um pequeno núcleo maciço e positivo, e fundamenta-se na teoria da radiação.
A teoria de Bohr fundamenta-se nos seguintes postulados:
1º postulado
Os elétrons descrevem, ao redor do núcleo, órbitas circulares com energia fixa e determinada. Tais órbitas chamam-se órbitas estacionárias.
2º postulado
Os elétrons movimentam-se nas órbitas estacionárias e, nesse movimento, não emitem energia espontaneamente.
3º postulado
Quando um elétron recebe energia suficiente do exterior, ele salta para outra órbita. Após receber essa energia, o elétron tende a voltar à sua órbita original, devolvendo a energia recebida. A energia recebida e devolvida é igual à diferença das energias das órbitas em que o salto ocorreu.
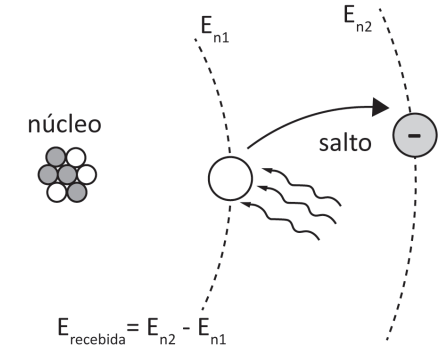
O elétron não “caminha” de uma órbita para outra. Ele absorve a energia fornecida até não ser mais permitido ficar na órbita em que se encontra. Aí, então, ele salta para uma órbita onde sua energia seja permitida. Quando isso ocorre, dizemos que o elétron está excitado.
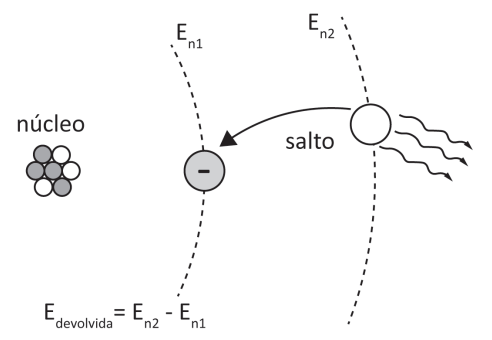
O elétron, agora excitado em uma órbita de maior energia, devolve a energia recebida na forma de radiação eletromagnética (luz ou calor) e salta novamente, retornando à sua órbita de origem.
De maneira geral, pode-se definir as seguintes características para o modelo de Bohr:
a) o átomo teria um núcleo positivo;
b) os elétrons negativos girariam ao redor do núcleo;
c) os elétrons girariam em órbitas bem definidas, mas teriam energia constante;
d) um elétron não assumiria qualquer valor de energia, mas determinados valores correspondentes às diversas órbitas permitidas, assim, teria determinados níveis de energia;
e) quando um elétron recebesse energia suficiente, saltaria para uma órbita mais energética.
NOTA COMPLEMENTAR
REGIÃO EXTRANUCLEAR (ELETROSFERA)
Os elétrons giram ao redor do núcleo apenas em determinadas órbitas, denominadas órbitas eletrônicas, camadas eletrônicas ou, ainda, níveis eletrônicos. Os níveis eletrônicos são designados a partir do núcleo, pelas letras K, L, M, N, O, P e Q. Uma vez que cada nível eletrônico possui uma energia bem definida, a expressão nível eletrônico é muitas vezes substituída por nível energético. Embora a energia destes níveis, à medida que se afastam do núcleo aumentem, a diferença de energia entre eles diminui.
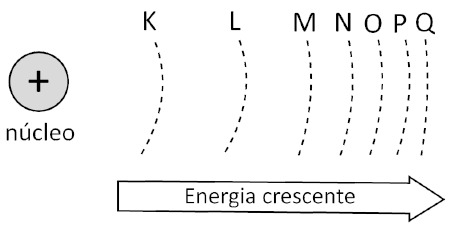
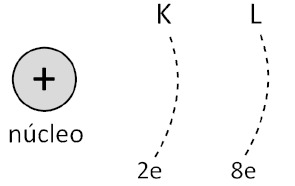
Cada nível energético contém um número máximo de elétrons. Por exemplo, os níveis K e L comportam no máximo, respectivamente, 2 e 8 elétrons.
O MODELO DE SOMMERFELD – UM COMPLEMENTO IMPORTANTE
A análise do espectro de elementos mais complexos levou Sommerfeld a propor que as órbitas não eram somente circulares, mas também elípticas.
Observação: A energia que o elétron desprendia em forma de luz, era devido ao fato de que as camadas eletrônicas possuíam algumas subdivisões, que ele chamou de subníveis de energia, aos quais estavam associados várias órbitas diferentes, sendo uma dessas órbitas circular e as demais elípticas.
ATUALIDADE ATÔMICA – A VIRADA DO SÉCULO
Atualmente, a ideia de átomo está bastante modificada. Isso não diminui ou invalida o feito de Dalton. Apesar de seu modelo ser muito simplificado e apresentar muitas incorreções, constituiu o ponto de partida de importantes conquistas no campo da estrutura da matéria.
Destacamos alguns nomes que muito contribuíram para a atomística do século XX:
JOSEPH JOHN THOMSON
Prêmio Nobel de Física (1906)
ERNEST RUTHERFORD
Prêmio Nobel de Química (1908)
NIELS HENRIK DAVI BOHR
Prêmio Nobel de Física (1922)
ARNOLD JOHANNES WILHELM SOMMERFELD e ERWIN SCHRÖEDINGER
Prêmio Nobel de Física (1933)
Nós vamos travar contato com alguns desses modelos atômicos, uns mais simples, outros mais sofisticados. Todos eles terão o seu campo de aplicação.
Certos fenômenos serão explicados por alguns modelos, outros serão explicados por modelos diferentes.




