LEUCIPO E DEMÓCRITO
Os modelos atômicos possuem início no século 500 a.C., período no qual viveram os filósofos gregos Leucipo e Demócrito. Ambos criaram a ideia do atomismo, na qual acreditava-se que, ao dividir a matéria sucessivamente, o produto seriam partículas invisíveis ao olho humano e indivisíveis, denominadas átomos.
A analogia poderia ser feita com a praia e a areia, por exemplo. Olhando de longe, têm-se a impressão de que a praia é formada por uma matéria contínua. Mas, quando se observa a areia de perto, vê-se que ela é composta por diversos grãos pequenos.
Aristóteles, um dos principais filósofos da antiguidade, discordou fortemente dessa ideia de átomo. Para ele a natureza era composta por quatro elementos básicos (ar, terra, fogo e água), que possuiriam propriedades fundamentais para caracterizar qualquer substância. Assim, Aristóteles acreditava na teoria de uma matéria contínua.
Logo, a teoria do atomismo deu início a uma série de estudos da matéria ao longo dos séculos, o que eventualmente gerou os chamados modelos atômicos.
MODELO ATÔMICO DE JOHN DALTON
A próxima grande definição feita na história a respeito da estrutura atômica ocorreu em 1803 com John Dalton, ao publicar os princípios de seu modelo atômico, que ficou conhecido como “Bola de Bilhar”.
Segundo Dalton, os princípios seriam os seguintes:
- O átomo é uma minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem cargas elétricas.
- Os átomos de elementos diferentes possuem propriedades diferentes entre si.
- Os átomos de um mesmo elemento possuem propriedades e peso iguais.
- Nas reações químicas os átomos permanecem inalterados.
- Na formação de compostos químicos, os átomos entram em proporções numéricas fixas, como 1/1, 1/2, 1/3, 2/3, etc.
- O peso de um composto é igual à soma dos pesos dos átomos que o compõe.
Os problemas do modelo de Dalton para a época é que ele não sabia explicar por que os átomos se ligam uns aos outros, como ocorrem rearranjos atômicos e nem como funcionam os fenômenos da eletricidade e os efeitos dos ímãs. Por isso, a questão do modelo atômico foi considerada ainda em aberto.
MODELO ATÔMICO DE THOMSON
Em seguida, veio Joseph John Thomson. Em 1897, Thomson descobriu o elétron através de um experimento em um tubo de raios catódicos. Para tanto, utilizou de uma ampola de Crookes e realizou descargas elétricas em um gás rarefeito (isto é, à baixa pressão). Com uma voltagem grande o suficiente, Thomson observou que eram formadas emissões, chamadas raios catódicos.
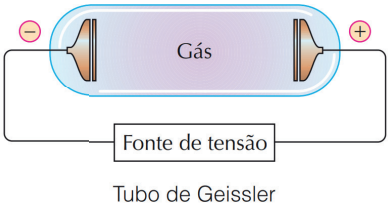
Figura retirada do livro Feltre vol.1
A fim de estudar mais a fundo o experimento, aplicou um campo elétrico transversal à ampola e viu que os raios catódicos eram desviados da placa negativa para a placa positiva. Assim, concluiu que esses raios eram de natureza negativa.
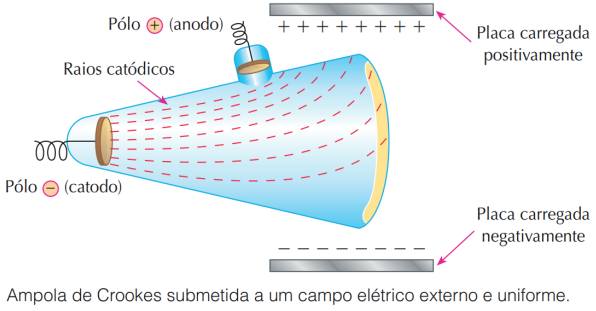
Figura retirada do livro Feltre vol.1
A descoberta de Thomson o fez imaginar e criar o seu próprio modelo atômico. Em especial, como descobriu os elétrons, ele sabia da existência de partículas menores do que o átomo de hidrogênio, de carga negativa, o que refutava a ideia de Dalton de que o átomo era a menor partícula possível. Através de seus experimentos, concluiu que a matéria seria formada por uma esfera de carga positiva, e corpúsculos de carga negativa distribuídas uniformemente ao longo dessa esfera, de modo que a carga total permanecia neutra. O seu modelo é conhecido como “Pudim de Passas”.
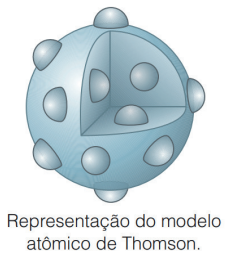
Figura retirada do livro Feltre vol.1
MODELO ATÔMICO DE RUTHERFORD
Ernest Rutherford foi um cientista neozelandês que realizou o seguinte experimento: com uma fonte radioativa (amostra de polônio envolvida por uma camada de chumbo), incidiu partículas alfa, de forma retilínea, em uma lâmina extremamente fina de ouro. Além disso, o cientista colocou um papel sensível atrás do aparato, de modo a detectar os impactos das partículas. O objetivo era observar o que aconteceria quando as partículas positivas tentassem atravessar os átomos.
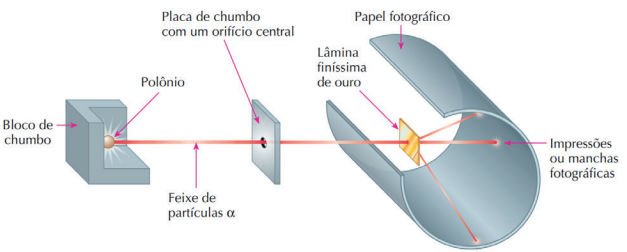
Figura retirada do livro Feltre vol.1
Assim, o cientista observou que uma porcentagem pequena das partículas era totalmente refletida, outra parte também pequena era parcialmente refletida, atingindo um anteparo colocado atrás da lâmina, e o resto, que representava a maior parte, passava direto. Esse fato descaracterizou o modelo de Thomson, pois, com um átomo maciço de carga positiva com cargas negativas incrustradas, o resultado esperado era que a maior parte fosse refletida completamente. Também percebeu que o número de partículas que sofriam grandes deflexões era extremamente baixo, o que o fez concluir que a parte positiva do átomo é muito pequena. Percebeu a presença dos elétrons pelas partículas que eram somente desviadas do caminho original, sem “rebater” na amostra de ouro, o que indicava que eram partículas positivas que sofriam atração eletrostática dos elétrons.
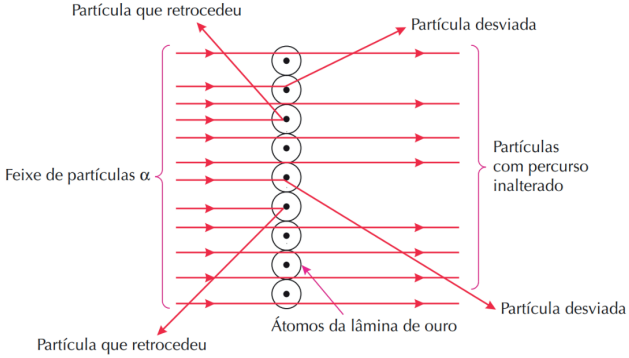
Figura retirada do livro Feltre vol.1
Com isso, Ernest Rutherford modelou o seu átomo, o qual seria formado por um núcleo positivo pequeno, onde a massa estaria concentrada e por elétrons que se moveriam em órbitas ao redor do núcleo, com um enorme espaço vazio entre os elétrons e o núcleo. O seu modelo ficou conhecido como “Modelo Planetário do Átomo”.
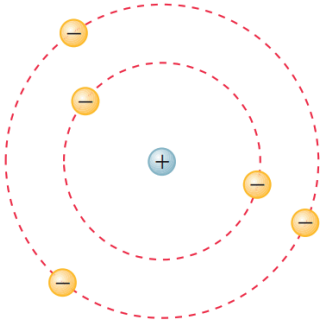
Figura retirada do livro Feltre vol.1
Postulou o seguinte com base nos seus experimentos:
- Os elétrons descrevem órbitas circulares estacionárias ao redor do núcleo, sem emitirem nem absorverem energia.
- Fornecendo energia a um átomo, um ou mais elétrons a absorvem e saltam para níveis mais afastados do núcleo. Ao voltarem às suas órbitas originais, devolvem a energia recebida em forma de luz.
- O núcleo é positivamente carregado.
- A região vazia em torno do núcleo é denominada eletrosfera e é o local onde os elétrons estão localizados.
Posteriormente, um cientista inglês James Chadwick explicou como o núcleo poderia conter diversos prótons, sem que esses sofressem extrema repulsão. Chadwick propôs a existência de partículas neutras, denominadas nêutrons, que também estariam presentes no núcleo e seriam capazes de isolar os prótons.
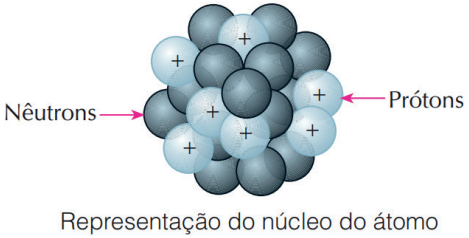
Figura retirada do livro Feltre vol.1
ÁTOMO DE BOHR
Com o desenvolvimento da física eletromagnética, Bohr notou que o modelo de Rutherford apresentava uma inconsistência forte. Segundo Rutherford, o elétron estaria em órbita circular ao redor do núcleo e, portanto, cada elétron estaria acelerado com uma componente centrípeta. Contudo, pela teoria do eletromagnetismo, toda carga elétrica submetida a uma aceleração emite onda eletromagnética. Pelo Princípio da Conservação da Energia, o elétron, ao emitir ondas eletromagnéticas, estaria perdendo energia cinética. Assim, a sua órbita teria o raio cada vez menor até o instante em que o elétron colidiria com o núcleo atômico.
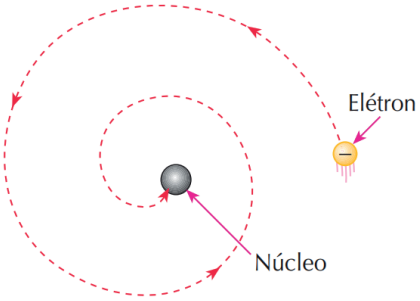
Figura retirada do livro Feltre vol.1
Portanto, o cientista Niels Bohr decidiu criar o seu modelo atômico, e o fez através dos seguintes postulados:
Os elétrons que circundam o núcleo atômico existem em órbitas circulares que possuem níveis de energia quantizados.
A energia total do elétron (cinética + potencial) não pode apresentar um valor qualquer, e sim valores múltiplos de um quantum.
Quando ocorre o salto de um elétron entre órbitas, a diferença de energia é emitida ou suprida por um quantum de luz (fóton), com energia igual à diferença de energia das órbitas final e inicial, fenômeno denominado salto quântico.
As órbitas permitidas para o elétron possui valor quantizado de momento angular, dado pela quantia: πL=nh/2π, onde n é o número quântico principal (n=1, 2, 3,…) e h é a constante de Planck.
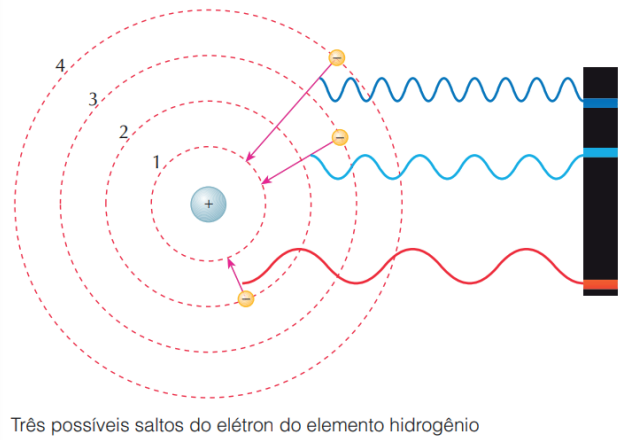
Figura retirada do livro Feltre vol.1
Apesar dos postulados acima, Bohr não sabia explicar essa quantização presente na estrutura dos átomos, sendo o seu modelo puramente baseado em um aspecto experimental.
No desenvolvimento a seguir, falaremos sobre a matemática envolvida no modelo de Bohr. Entretanto, vale ressaltar que o modelo se aplica apenas a átomos hidrogenoides, isto é, átomos formados por apenas um elétron, pois Bohr não contava com o efeito de repulsão entre os elétrons de camadas distintas. Considerando um átomo hidrogenoide com número atômico Z, temos que a força de atração entre o elétron e o núcleo é:

Onde e é a carga elementar (é a mesma para prótons e elétrons), ε0 a permissividade do meio e R o raio atômico. Como essa força atuante é a componente centrípeta, temos:

Onde m é a massa do elétron. Além disso, o momento angular do elétron é quantizado:

Com isso, obtemos:

Onde a quantidade R0 é equivalente ao primeiro raio da órbita do hidrogênio, denominada Raio de Bohr:

Como a energia do elétron é dada por:

Sendo E0 a energia da primeira camada do átomo de hidrogênio:

Posteriormente ao modelo de Bohr, um físico alemão chamado Arnold Johannes Wilhelm Sommerfeld desenvolveu o seu modelo atômico, em 1915, estudando os espectros de emissão de átomos mais complexos que o hidrogênio. O físico sugeriu que além de órbitas circulares, os elétrons também poderiam realizar órbitas elípticas com diversas formas, dando origem à subníveis de energia ou subcamadas.
MODELO ATÔMICO ATUAL
O principal problema do modelo de Bohr foi se basear somente na física clássica. Sabe-se, hoje em dia, que os fenômenos atômicos e subatômicos são, em sua maioria, quânticos. Ainda prevalece, contudo, o fato de o núcleo ser pequeno, denso e positivo, assim como a neutralidade atômica.
Em suma, o modelo atual se baseia fortemente na física quântica, com os seguintes princípios:
PRINCÍPIO DA DUALIDADE (OU DE DE BROGLIE)
Com base nos experimentos do século XIX, concluiu-se que a luz apresentava ora comportamento de partícula ora comportamento de onda. Então, o físico Louis De Broglie lançou a teoria de que, assim como a luz, que era considerada apenas onda, poderia se comportar como partícula, a partícula também pode apresentar características ondulatórias. Para o modelo atômico, afirmou que todo elétron possui uma onda característica associada ao seu movimento. Sendo h a constante de Planck, a equação que faz a relação entre o comprimento de onda λλ associado uma partícula de massa m em movimento (velocidade v ou quantidade de movimento p) é:

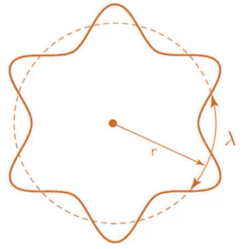
Considerou também que, como o elétron se comporta também como onda, temos para o átomo de Bohr que cada circunferência de órbita do elétron deve ser um múltiplo do comprimento de onda equivalente do elétron:
2πR = nλ
PRINCÍPIO DA INCERTEZA
Em 1926, o físico alemão Werner Karl Heisenberg observou que é impossível medir simultaneamente os valores de velocidade e posição de um elétron. Pode-se saber apenas a velocidade do elétron em determinado instante ou a sua posição, mas não ambos ao mesmo tempo. Isso ocorre porque para conhecer a posição ou velocidade de um elétron, é necessário incidir sobre ele um tipo específico de radiação, o qual depende de qual dos dois parâmetros se deseja medir. Como o elétron apresenta comportamento ondulatório, essa radiação vai interferir nos parâmetros secundários.
Por exemplo, para saber a posição do elétron, incide-se radiação sobre ele. Para obter menor incerteza na posição, a radiação deve possuir o menor comprimento de onda possível. Assim, quando a radiação interagir com o elétron, haverá uma troca de energia de λΔE=hf=h/λ. Como o valor de λλ deve ser pequeno, nota-se que a energia trocada será extremamente alta. Assim, o elétron terá um ganho considerável de energia cinética e, portanto, a velocidade calculada não será a velocidade real que o elétron possuía.
A equação que relaciona as incertezas é dada por:

Onde Δx é a incerteza na posição, Δp é a incerteza na quantidade de movimento, h é a constante de Planck e πℏ=h/2π é a constante reduzida de Planck.
PRINCÍPIO DO ORBITAL
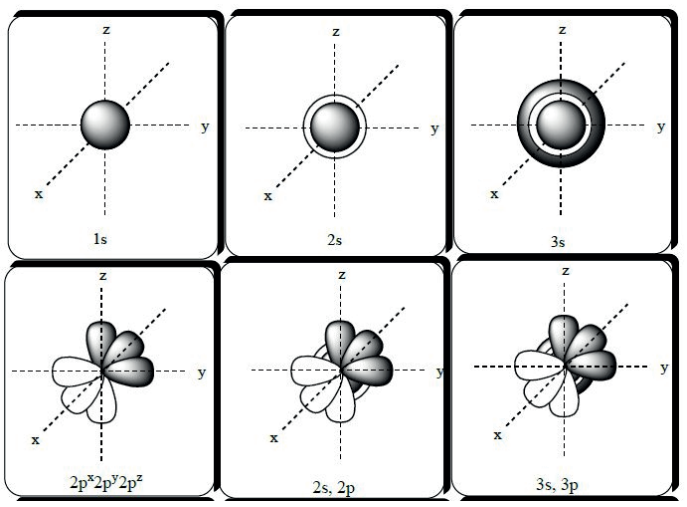
Em 1926, o físico austríaco Erwin Schrödinger propôs que os elétrons não se movem em órbitas bem definidas ao redor do núcleo, mas sim de modo aleatório em regiões concêntricas do núcleo denominadas orbitais. Essas regiões seriam caracterizadas formalmente como a região do átomo de probabilidade máxima de se encontrar o elétron.
Em 1926, o físico austríaco Erwin Schrödinger propôs que os elétrons não se movem em órbitas bem definidas ao redor do núcleo, mas sim de modo aleatório em regiões concêntricas do núcleo denominadas orbitais. Essas regiões seriam caracterizadas formalmente como a região do átomo de probabilidade máxima de se encontrar o elétron.
PRINCÍPIO DA EXCLUSÃO DE PAULI
Em 1925, o físico Wolfgang Pauli formulou um princípio da física quântica em que afirma que dois elétrons de um mesmo átomo não podem ter o mesmo estado quântico simultaneamente. Assim, em outros termos, dois elétrons não podem estar no mesmo orbital e com a mesma velocidade vetorial. Para cada orbital pode-se ter no máximo dois elétrons com velocidades vetoriais opostas.
REGRA DE HUND
Em 1925, o químico alemão Friedrich Hermann Hund propôs o princípio da máxima multiplicidade, em que afirma que a energia de um orbital semipreenchido é menor do que a energia de um orbital completamente preenchido. Assim, os elétrons de um átomo devem ser colocados de tal forma que o número de orbitais semipreenchidos seja máximo.
Em 1905, Einstein propôs que a radiação eletromagnética era quantizada por uma quantidade elementar chamada fóton. Isto é, a luz seria composta por diversos “pacotes” menores de energia dada por:
E=hf
Onde h é a constante de Planck e f a frequência do fóton / luz. Assim, sempre que a luz é absorvida ou emitida por um corpo, esse processo ocorre nos átomos do corpo, sendo essa troca energética realizada por meio dos fótons. Na absorção de luz, temos que um fóton é aniquilado e, na emissão, um fóton é gerado.
EFEITO FOTOELÉTRICO
O Efeito Fotoelétrico é a emissão de elétrons por um material (metálico, em geral) quando exposto a uma radiação eletromagnética de frequência suficientemente alta. O valor da frequência mínima depende do material utilizado. Os elétrons emitidos através desse efeito recebem o nome de fotoelétrons. Esse fenômeno é utilizado por exemplo no funcionamento de óculos de visão noturna e portas automáticas.
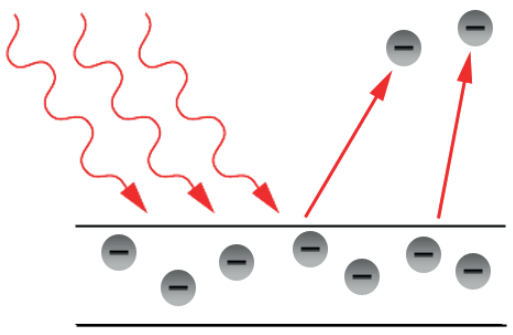
A explicação do efeito é a seguinte: a luz, ao entrar em contato com a superfície metálica, faz com que os elétrons do metal recebam e absorvam fótons (cada elétron um fóton respectivamente). Como os fótons são energéticos, os elétrons recebem a energia dos fótons e, se essa energia for pelo menos a energia de ligação dos elétrons, eles são ejetados do metal. Se a energia dos fótons for maior do que a energia de ligação, os elétrons, além de serem ejetados do metal, recebem energia cinética. Sendo h a constante de Planck e f a frequência do fóton, temos que a energia do fóton é:
Sendo Ec a energia cinética adquirida pelos elétrons e ϕ a função trabalho do metal (isto é, a energia mínima para ejetar os elétrons) temos:
Se E = hf > ϕ → Ec = hf – ϕ
Se E = hf < ϕ → Ec=0 elétrons não ejetados
Vale lembrar que essa energia cinética considerada na equação acima é a energia cinética máxima possível dos elétrons. Isso porque há elétrons em camadas diferentes, com energias de ligação distintas e, portanto, cada elétron, se ejetado, vai adquirir uma energia cinética diferente. Ao utilizar-se de uma diferença de potencial UAB para desacelerar os elétrons (de carga e), temos que o trabalho realizado é:
Considerando que o potencial é suficiente para desacelerar completamente os elétrons, teremos:
W + Ec = 0 → eUAB = hf – ϕ
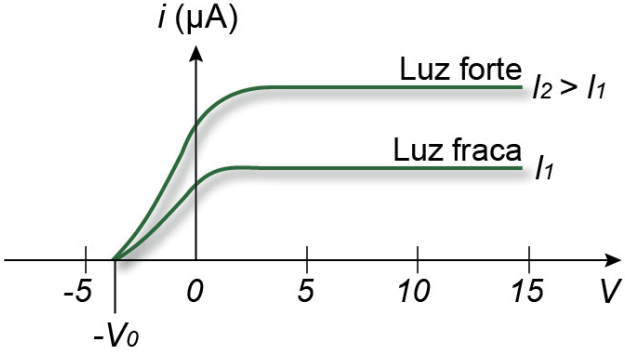
Onde o potencial UAB é denominado potencial de corte. A frequência mínima para a emissão dos elétrons é denominada frequência de corte.
Um fator de extrema importância é que a emissão dos elétrons não depende da intensidade I da luz incidente, apenas da frequência. O motivo é que cada elétron troca energia com um fóton apenas e a intensidade da luz altera a taxa de fótons que são incididos em determinada área do metal. Assim, aumentar a intensidade da luz vai fazer com que mais elétrons sejam emitidos (maior corrente) somente se a frequência da luz for a mínima suficiente. Caso a frequência seja menor do que a frequência de corte, aumentar a intensidade da luz não vai gerar a emissão de elétrons, vai apenas fazer com que a amostra receba mais fótons de energia insuficiente.
(V é o potencial UAB)
Alguns componentes tecnológicos funcionam à base do efeito fotoelétrico. Desses pode-se citar o sensor fotoelétrico, o qual responde eletricamente às variações de intensidade de luz que incide sobre ele e o LDR (resistor dependente de luz), de resistência variável também de acordo com a intensidade luminosa. Outro exemplo é na radiografia, onde ondas eletromagnéticas de raio X (radiação de alta frequência) são utilizadas determinar materiais de composição não uniforme. Isso é possível porque a densidade e composição de cada área do material analisado está diretamente relacionada com a absorção de raio X. Pelo efeito fotoelétrico e o efeito de Compton, consegue-se determinar imagens radiográficas, as quais possuem tonalidades de cor de cinza que variam de acordo com a interação fóton-elétron na matéria de cada área do corpo.




