MISTURAS OU DISPERSÕES
Quando duas ou mais substâncias puras se encontram num mesmo recipiente, passamos a constituir uma mistura ou dispersão.
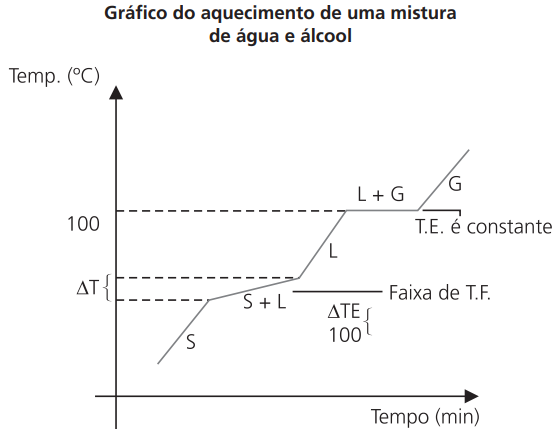
O aquecimento de uma mistura faz com que a temperatura de fusão, a temperatura de ebulição, ou ambas, apresentem uma variação de seu valor em função do tempo de aquecimento.
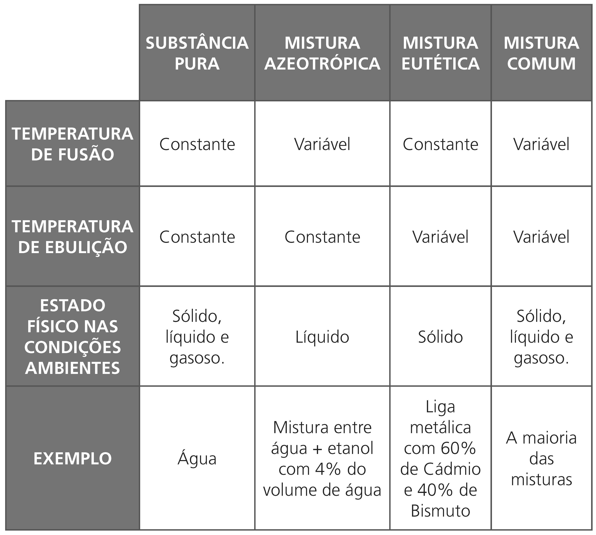
Os gráficos e a tabela abaixo mostram a diferença de aquecimento de uma substância pura e os tipos de misturas:
GRÁFICOS DE AQUECIMENTO
Fazem uma análise técnica do aquecimento e/ou resfriamento de uma substância pura ou mistura, mostrando suas diferenças.
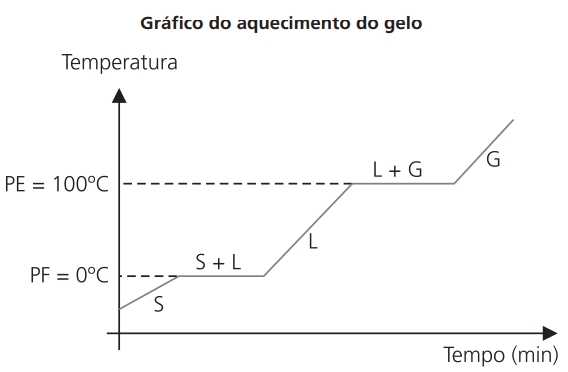
CURVA DE AQUECIMENTO DE UMA SUBSTÂNCIA PURA
As duas mudanças de fase ocorrem à temperatura constante (característica da substância pura).
Água: P.F. = 0 o C
P.E. = 100 o C
(Fonte: http://educar.sc.usp.br)
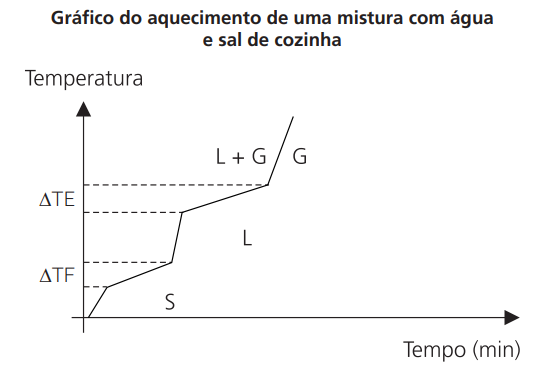
CURVA DE AQUECIMENTO DE UMA MISTURA QUALQUER
As duas mudanças de fase ocorrem com variação de temperatura.
(Fonte: http://educar.sc.usp.br)
Note que não temos patamar.
Contudo, é importante observar que existem misturas que acabam comportando-se como se fossem substâncias puras, diante dos fenômenos de fusão/solidificação ou de ebulição/condensação. No primeiro caso, temos uma mistura eutética, ou simplesmente um eutético, que funde/solidifica em temperatura constante; é o que acontece com uma liga metálica que contenha 62% de estanho e 38% de chumbo e que funde à temperatura constante de º183 ºC. No segundo caso, temos uma mistura azeotópica, ou simplesmente um azeótropo, que ferve/condensa em temperatura constante; por exemplo, uma mistura com 96% de álcool comum e 4% de água, em volume, que ferve à temperatura constante de 78,1 °C.
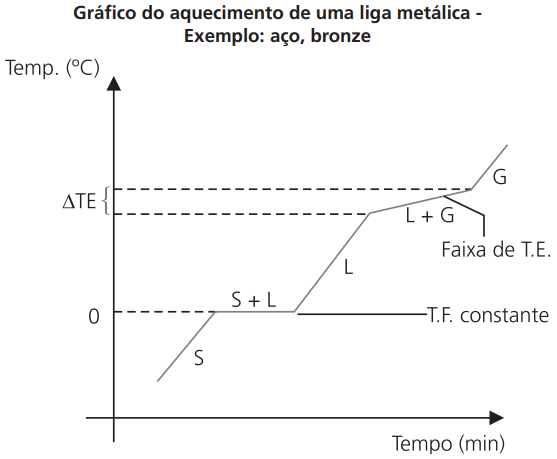
CURVA DE AQUECIMENTO DE UMA MISTURA EUTÉTICA
(Fonte: http://educar.sc.usp.br)
Note que temos um patamar, isto é, durante a fusão a temperatura permanece constante, logo, apresenta ponto de fusão.
MISTURA EUTÉTICA – aquela que se comporta como substância pura ao longo da fusão.
CURVA DE AQUECIMENTO DE UMA MISTURA AZEOTRÓPICA
(Fonte: http://educar.sc.usp.br)
Note que temos um patamar, isto é, durante a ebulição a temperatura permanece constante, logo, temos um ponto de ebulição.
MISTURA AZEOTRÓPICA – aquela que se comporta como substância pura ao longo da ebulição.
Observação:
Para uma substância pura se caracterizar como tal, algumas outras constantes físicas, além do ponto de fusão e de ebulição, são muito importantes.
- A densidade ou massa específica, que é o quociente da massa pelo volume da substância. Matematicamente:

A densidade dos líquidos é medida diretamente pelos densímetros, como os existentes em bombas de álcool nos postos de gasolina. De acordo com as densidades, costuma-se dizer, em linguagem popular, que, por exemplo: o alumínio é “leve” (d = 2,7 g/cm3), enquanto o chumbo é “pesado” (d = 11,4 g/cm3); o correto seria dizer que o alumínio é menos denso que o chumbo.
- O calor específico, que é a quantidade de calor necessária para aumentar de 1 °C, a temperatura de 1 g da substância. Assim, por exemplo, 1 g de água necessita de 1 cal para ter sua temperatura aumentada de 1 °C; dizemos então que o calor específico da água é 1 cal/g·°C.
- A solubilidade, que é, por exemplo, a maior quantidade (em gramas) da substância que podemos dissolver numa dada quantidade de um líquido (em geral em litros), a uma dada temperatura.
Por exemplo, podemos dissolver, no máximo, 365 g de sal comum em 1 L de água a 20 °C.
Sendo específicas para uma dada substância pura, as constantes físicas nos permitem identificá-Ia e caracterizá-Ia.
Como foi discutido, quando duas ou mais substâncias puras se encontram num mesmo recipiente, passamos a constituir uma mistura ou dispersão. As misturas apresentam propriedades físicas variáveis.
FASES DE UMA MISTURA
As fases de uma mistura estão associadas à dimensão das partículas das substâncias (componentes) presentes na mistura.
DISPERSANTE OU DISPERGENTE
É o componente da mistura que geralmente se apresenta em maior quantidade.
DISPERSO(S)
É (são) o(s) componente(s) da mistura que geralmente se apresenta em menor quantidade.
TIPOS DE MISTURA
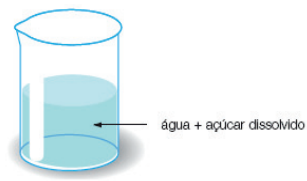
MISTURAS HOMOGÊNEAS, SOLUÇÕES VERDADEIRAS OU SOLUÇÕES
Quando o diâmetro da partícula de um disperso é, em média, igual ou inferior a 1 nanômetro (nm). As soluções são misturas apresentam uma única fase (unifásica) quando observada a olho nu ou mesmo com o auxílio de um microscópio. Nessas misturas, o dispersante recebe o nome de solvente e os dispersos são chamados de soluto.
Fonte: https://www.estudopratico.com.br
Quanto ao estado físico dos componentes e da mistura, podemos ter as seguintes misturas homogêneas:
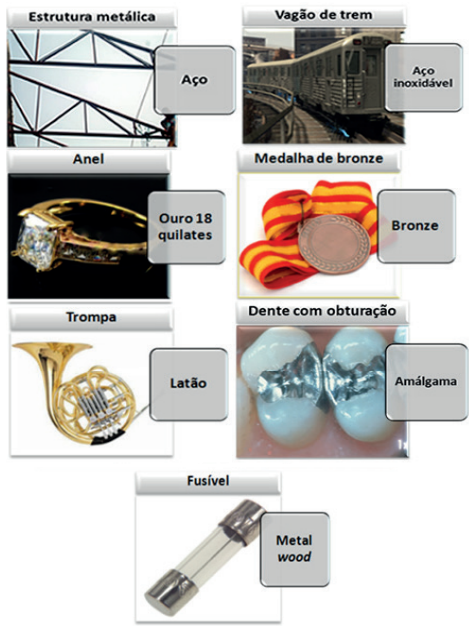
Estado Sólido → Ligas Metálicas
Exemplos: Bronze (Liga de Cobre com Estanho); Amálgama (Ligas metálicas que apresentam o metal Mercúrio); Ouro 18 quilates (além do ouro, também apresenta o metal cobre).
Fonte: https://alunosonline.uol.com.br
Estado Líquido
- Líquidos Miscíveis:
Exemplo: água + etanol

Fonte: http://www.dentalestilo.com.br
- Sólido totalmente solúvel num líquido:
Exemplo: soro fisiológico (solução aquosa de Cloreto de Sódio)

Fonte: https://www.lojaagropecuaria.com.br
Estado Gasoso
- Toda mistura de substâncias gasosas (gases) é HOMOGÊNEA.

Fonte: https://lista.mercado livre.com.br
No interior do botijão de gás para cozinha e aquecer alimentos, temos muitas substâncias gasosas misturadas. Destacamos, entre elas, o gás butano, que serve de combustível e o tercbutilmercaptan, responsável pelo seu forte odor, necessário para alertar em caso de vazamento.
MISTURAS HETEROGÊNEAS
Quando o diâmetro da partícula de um disperso é, em média, superior a 1 nanômetro (nm).
As misturas heterogêneas apresentam duas ou mais fases (polifásicas). Essas fases podem ser observadas a olho nu (Suspensões) ou com o auxílio de um microscópio (Soluções Coloidais).
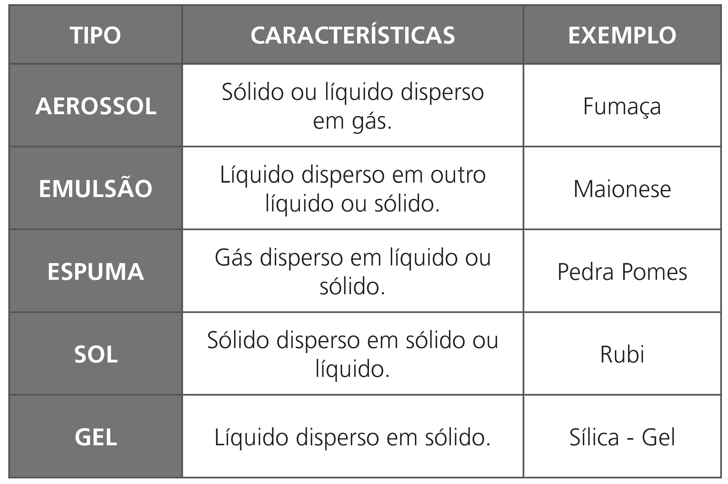
- Soluções Coloidais ou Coloides
São misturas heterogêneas que apresentam o diâmetro médio da partícula inferior a 100 nm. Essa dimensão não permite uma diferenciação visual das fases, desta forma, é necessário o uso de um microscópio.
São tipos de Coloides:
Maionese

Fonte: https://anamariabraga. globo.com
Sangue
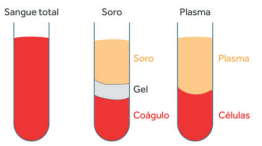
Fonte: https://kasvi.com.br
Fumaça
Fonte: https:// palavrasdeumalguem. wordpress.com
Rubi

Fonte: http://www.mfrural.com.br
- Suspensões ou Misturas Heterogêneas Grosseiras
São misturas que apresentam o diâmetro médio da partícula superior a 100 nm. Essa dimensão permite uma diferenciação visual das fases.
Exemplos:
Mistura de sólidos → Minérios em geral

Fonte: https://br.depositphotos.com
Mistura de líquidos imiscíveis → Óleo + água

Fonte: https://br.depositphotos.com
Mistura de Sólido e Gás → Poeira

Fonte: http://www.agenciadanoticia.com.br




