Misturas gasosas
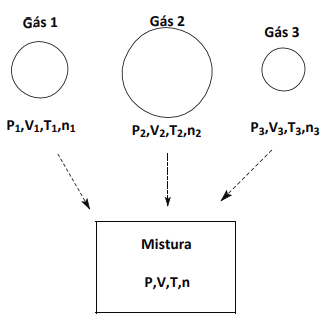
Considerando-se que a única grandeza que apresenta aditividade é o número de partículas (número de mols), temos:

Exemplo:
Temos um recipiente com N2 puro e outro com O2 puro. Volumes e pressões iniciais estão assinalados no esquema seguinte.
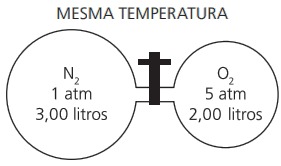
Abrindo a torneira que separa os gases e mantida a temperatura, a pressão interna se estabiliza no valor de:
Resolução:

LEI DE DALTON
A pressão total (P) de uma mistura de gases que ocorre numa temperatura constante é a soma das pressões parciais(p) dos componentes da mistura.
P = p1 + p2 + p3 +…pi ou P = Σp → p = xiP
Pi → pressão parcial do componente i.
xi → fração molar do componente i na mistura gasosa.

LEI DE AMAGAT (VOLUME PARCIAL)
Numa mistura gasosa, volume parcial de uma gás é volume que ele irá ocupar sozinho e sendo submetido à pressão total e a temperatura da mistura.
V = v1 + v2 + v3+…+vi ou V =∑vi → v =xiV
Exemplo:
Considere a mistura de 0,5 mol de CH4 e 1,5 mol de C2H6 contidos num recipiente de 30,0 litros a 300 K. A pressão parcial do CH4, em atmosfera, é igual a:
Dado: R = 0,082 atm ⋅ L ⋅ mol-1 ⋅ K-1.
Resolução:
Cálculo da Fração Molar de CH4:

Cálculo da Pressão Total:

Cálculo da Pressão Parcial do CH4:





