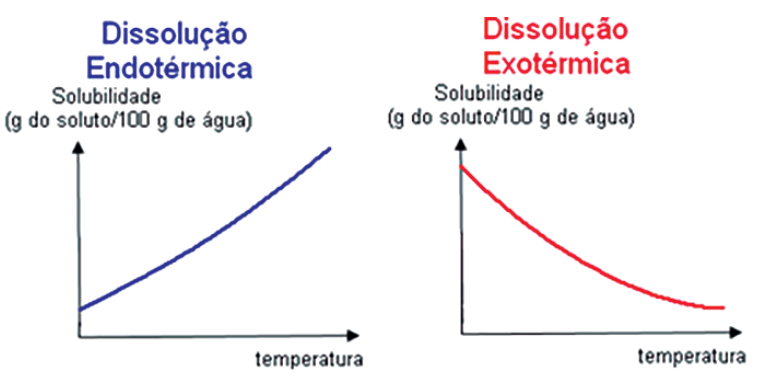
ENTALPIA DE DISSOLUÇÃO
O processo de dissolução de um soluto num solvente implica da quebra e formação de ligações entre átomos ou íons, no caso das soluções iônicas, entre moléculas, no caso das soluções intermoleculares, e na formação de ligações do tipo, íon dipolo, para solvatar solutos iônicos e intermoleculares, para as soluções moleculares. Esse fato, nos deixa claro que seria, à princípio, um processo que ocorre com absorção ou liberação de calor, gerando um entalpia de dissolução
Exemplo: dissolução do sulfato de lítio, Li2SO4:
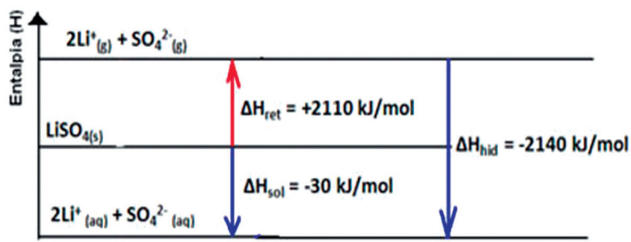
Li2SO4 (s) + H2O(aq) → Li2SO4 (aq) ΔH = -30 kJ × mol-1
TIPOS DE DISSOLUÇÕES
SOLUÇÃO IDEAL
É aquela na qual a entalpia de solução é zero. Todas as forças intermoleculares são iguais, sejam as moléculas semelhantes ou não, onde a variação do volume da mistura também será zero. Quanto mais próxima de zero for o valor da entalpia de solução, mais “ideal” é a solução.
LEI DE RAOULT
“Quando um líquido é acrescentado a uma mistura homogênea e de comportamento ideal, numa dada temperatura, ocorre uma diminuição de sua pressão de vapor proporcional à sua fração molar na mistura na mesma temperatura:
P = x (P°), onde:
- P→pressão de vapor do líquido na mistura.
- Po→pressão de vapor do líquido puro.
- x→fração molar do líquido na mistura.
Como o somatório das frações molares é sempre igual a 1, podemos então concluir que pressão de vapor da mistura é o somatório das novas pressões de vapor obtida por cada líquido misturado.
P(mistura) = Pi + Pj = xi(Po)i + xj(Po)j
A composição de cada substância da mistura na fase vapor pode ser obtida aplicando a Lei de Dalton para os Gases:
yi e yj → frações molares das substâncias i e j na fase vapor:
%20de%20líquidos/mistura%20-%201.png)
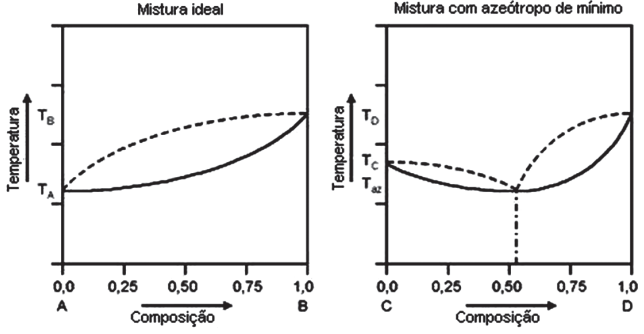
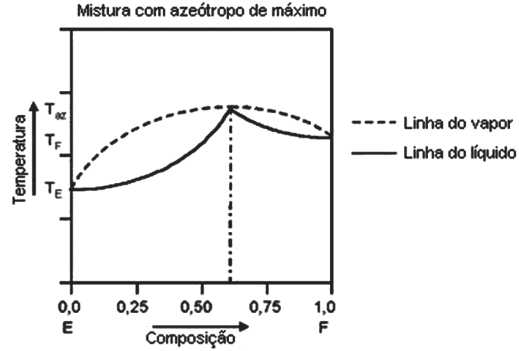
SOLUÇÕES NÃO IDEAIS
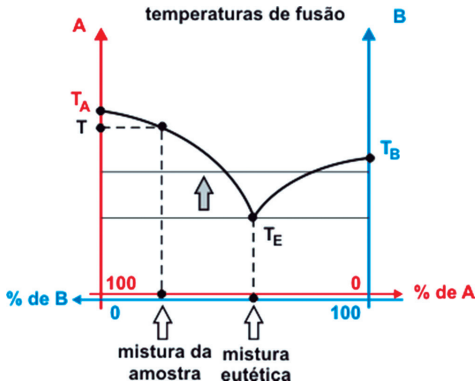
Quando na fase líquida, pode originar as misturas azeotrópicas ou azeótropos e quando na fase sólida pode originar as misturas eutéticas ou eutético.
- SOLUÇÃO IDEAL E MISTURAS AZEOTRÓPICAS
- MISTURA EUTÉTICA
As ligas metálicas, onde muitas apresentam comportamento eutético, são misturas de metais que foram misturados na fase líquida e que depois se solidificou por resfriamento, por esse motivo, são também tratadas como soluções, mas tendo a temperatura de fusão como referência de análise.
- DESTILAÇÃO FRACIONADA
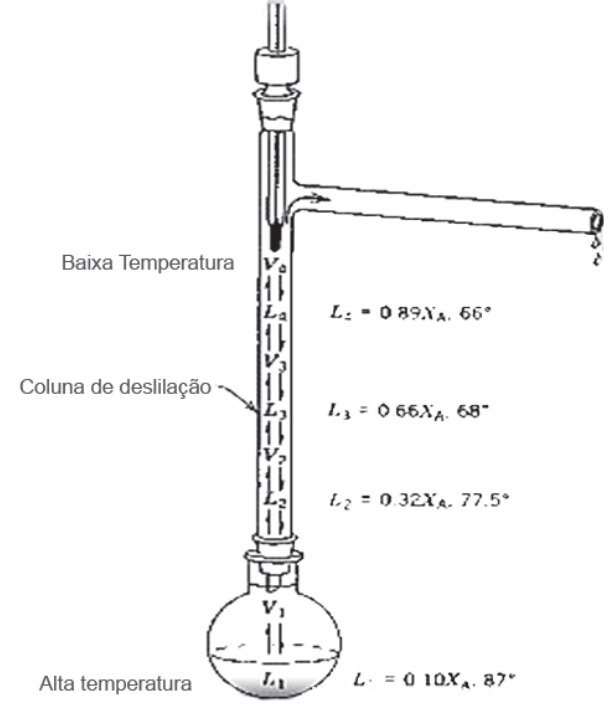
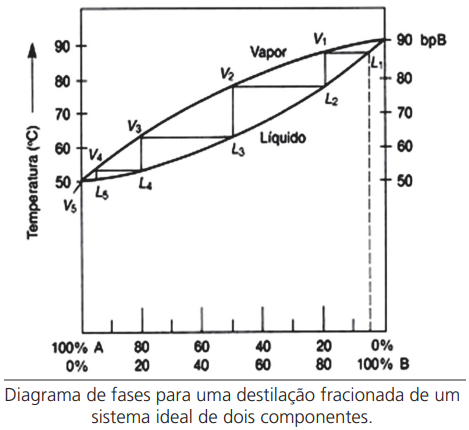
Exemplo: uma mistura líquida homogênea contendo Benzeno e Octano se encontram num laboratório na temperatura de 20º e pressão de 1 atm. A mistura apresenta 20% em massa de benzeno. Considerando as informações contidas na tabela 1 e os dados abaixo, Responda:
a) Qual das misturas poderia apresentar uma maior proximidade de comportamento de solução ideal.
b) Considerando que o calor de vaporização do benzeno é igual a 30,8 KJ ⋅ mol-1 e que a sua temperatura de ebulição tabelada é de 80,1º C, qual seria a margem de erro para o calcula da sua temperatura de ebulição usando a equação de Clausius-Clapeyron? Dados: Massas molares: Benzeno = 78 g ⋅ mol-1; Octano = 114 g ⋅ mol-1.
Resolução:
a) Dados: T = 20ºC ou 293 K; (Po)benzeno = 76,7 mmHg ou 0,100 atm; (Po)octano = 10,04 mmHg ou 0,013 atm.
Calculando o número de mols dos componentes para 100g de mistura:
(n)benzeno = 20/78 =0,256 mol; (n) octano = 80/114 = 0,702 mol
Calculando as frações molares dos componentes:
(x) benzeno =[0,256/(0,256+0,702)] = 0,27; (x) octano = 1 – 0,27 = 0,73
Calculando a pressão de vapor da mistura:
(P)mistura = [(x) benzeno · (P°) benzeno] + [(x) octano · (P°) octano] =
=(0,27)(0,100) + (0,73)(0,013) = 0,036 atm
Calculando as frações molares dos componentes na fase gasosa:
[(P) mistura · (y)benzeno] = [(x) benzeno · (Po) benzeno] →
(y)benzeno=[(0,27)(0,100)/0,036] = 0,75
(y) octano=1 – · (y) benzeno = 1 – 0,75 = 0,25
Porcentagens molares na mistura gasosa:
Benzeno = 75%; Octano = 25%
b) Dados: T=20°C ou 293 K → (P) benzeno =76,7mmHg ou 0,100 atm
Para a equação de Clausius – Clapeyron:
P1 =1 atm, P2 = 0,100 atm e T1 = 293 K
log(1 atm/0,01 atm) =[(-30, 8 × 103 J/(2,303)(8,31 J · mol-1 K-1)][(1/293) – (1/T2)]K-1
Efetuando os cálculos, temos: T2 = 383,4 K ou 110,4°C.
Calculando a margem de erro:
%20de%20líquidos/mistura%20-%202.png)




