Por apresentarem esta relação estequiométrica, torna-se possível determinar informações tais como a concentração de soluções desconhecidas.
A operação que permite determinar concentrações desconhecidas a partir da adição de uma solução de concentração conhecida com a ocorrência de uma reação química entre um ácido e uma base chama-se titulação.
A titulação é feita pela reação entre um ácido e uma base, onde a concentração de um deles é conhecida e a do outro não. Conhecida uma das concentrações, adiciona-se lentamente, sobre a solução que se deseja determinar a concentração, o líquido contendo a solução de concentração conhecida. A partir do volume de solução utilizado, é possível determinar a concentração da solução de concentração desconhecida.
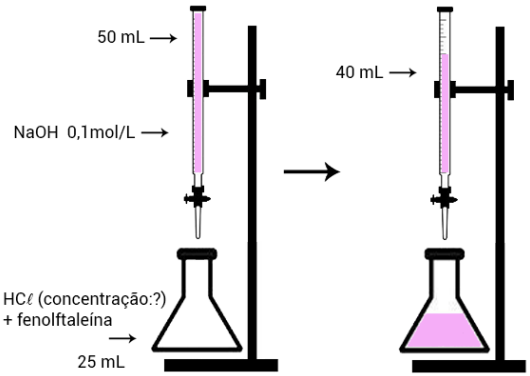
A titulação ocorre na presença de um indicador ácido-base, que será o responsável por indicar o ponto em que a reação terminou, a partir da mudança de coloração da solução. Esse ponto é chamado de ponto de equivalência.
A titulação também pode ser realizada pela adição da solução de concentração desconhecida sob a solução de concentração conhecida.
Para realizar a titulação, é necessário conhecer: a concentração de uma das soluções; o volume da solução desconhecida e o volume da solução conhecida. A partir dessas informações, será possível calcular a concentração da solução desconhecida.
CURVAS DE TITULAÇÃO
É o gráfico que procura indicar o valor do pH da mistura reacional em função do volume adicionado de solução titulante.
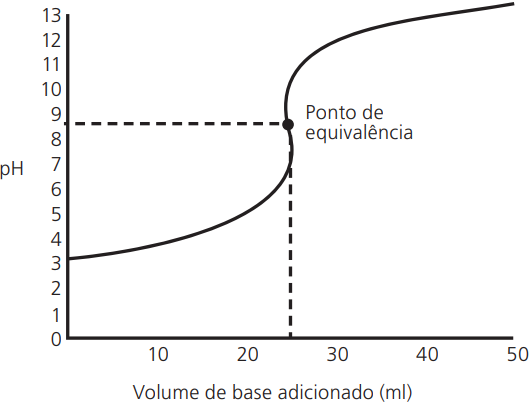
O gráfico acima descreve a titulação de um ácido fraco por uma base forte. Essa informação se confirma, pois o pH do ponto de equivalência apresenta valor superior a sete (7).
Exemplo 1: quantos mililitros de solução 0,2 mol⋅L-1 de hidróxido de sódio devem ser utilizados na neutralização total de 15 mL de solução 2 mol⋅L-1 de ácido sulfúrico totalmente ionizado?
Resolução:
/Mistura%20de%20solutos%20-%201.png)
No ponto de equivalência: 2nA = nB→ 2( 2 mol · L-1)(15 mL) = (0,2 mol · L-1) VB → VB = 300 mL.
Mistura Aleatória de Soluções → é quando podemos ter excesso de reagente.
Nesse caso, devemos calcular o número de mols de cada reagente antes da mistura para verificarmos a existência ou não de reagente em excesso.
Exemplo: misturou-se 200 mL de solução aquosa 0,02 mol⋅L-1 de ácido nítrico com 300 mL de solução 0,01 mol⋅L-1 de hidróxido de potássio (KOH).
a) Após a mistura, a solução final será ácida, básica ou neutra.
b) Qual é a concentração, em mol por litro, do reagente que se encontra em excesso, se houver.
Resolução:
/Mistura%20de%20solutos%20-%202.png)
No ponto de equivalência: nA = nB
nA = 0,02 mol · L-1(0,2 L)=2 · 10-3 mol
nB = 0,01 mol ·L-1(0,3 L)=3 · 10-3 mol
Esses valores revelam que a base (KOH) se encontra em excesso. Logo, a solução final será básica.
b) n (excesso) = (3 · 10-3) – (2 · 10-3) = 1 · 10-3 mol
V(final)=0,2+0,3=0,5 L
[KOH] ( excesso) = 1 . 10-3 mol /0,5 L = 2 . 10-3 mol . L -1




