MISTURA DE SOLUÇÕES DE MESMO SOLUTO
Trata-se da união de duas soluções que possuem o mesmo soluto. Como trata-se do mesmo soluto, não há reação química. Porém, haverá mudança de concentração, uma vez que o volume sofrerá alteração após a mistura. Além disso, no caso de solutos iguais sendo misturados, a concentração também será afetada pela variação da quantidade de soluto.
Considere duas soluções aquosas de sacarose contidas em dois frascos diferentes. Essas duas soluções, ao serem misturadas, formarão uma mistura final cuja quantidade total do número de mols de sacarose existente no frasco será:
nr + n2 = nf
Sabendo que n=M·V, e substituindo em n1,n2 en nf tem-se que:
M1 · V1 + M2 · V2 = Mf · Vf
O volume final é a soma do volume contido no fraco 1 e o volume contido no frasco 2 :
V1 + V2 = Vf
A mesma relação é válida quando se trata da concentração comum, C:
C1 · V1 + C2 · V2 = Cf · Vf
MISTURA DE SOLUÇÕES DE SOLUTOS DIFERENTES QUE NÃO REAGEM ENTRE SI
Nessa operação, como os solutos são diferentes e não reagem entre si, deve-se proceder como se cada solução em particular tivesse sofrido uma diluição.
Para tal, utiliza-se a mesma fórmula de diluição para cada um dos solutos existentes na solução.
C1 · V1 = Cf · Vf ou M1 · V1 = Mf · Vf
Exemplo: 1,0 litro de uma solução de CaCℓ2 2,0 mols/L foi misturada a 3,0 litros de uma solução de NaCℓ 1,0 mol/L. Determine a concentração resultante, em mol/L, em relação ao NaCℓ e ao CaCℓ2.
Solução:
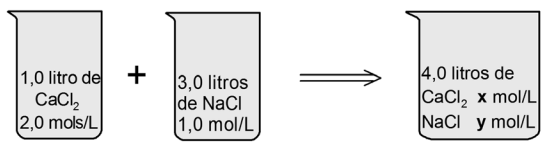
Para CaCℓ2: a concentração final será calculada como se a solução de CaCℓ2 tivesse sofrido uma diluição pelo acréscimo de 3,0 litros de solvente (volume da solução de NaCℓ)
M1 · V1 = Mf · Vf
2,0 · 1,0 = Mf · 4,0
Mf = 0,5 mol/L
Para o NaCℓ: a concentração final será calculada como se a solução de NaCℓ tivesse sofrido uma diluição pelo acréscimo de 1,0 litro de solvente (volume da solução de CaCℓ2).
Mi . Vi = Mf . Vf
1,0 . 3,0 = Mf . 4,0
Mf = 0,75 mol/L




