CISÕES MOLECULARES
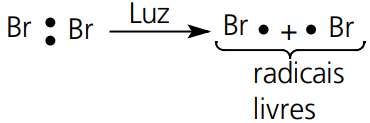
Homólise ou Cisão Homolítica:
Ocorre em presença de luz, calor ou peróxidos.
Ocorre uma ruptura de ligação de forma que cada átomo fica com o seu elétron. Originam estruturas neutras, porém com elétrons desemparelhados denominados de radicais livres.
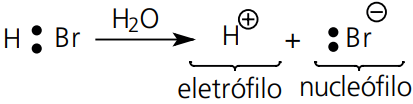
Heterólise ou Cisão Heterolítica:
Ocorre em presença de solventes ou catalisadores.
Ocorre uma ruptura de ligação de forma que um dos átomos fica com os dois elétrons da mesma.
Originam estruturas diferentes, uma falta de par eletrônica, denominada de eletrófilo ou agente eletrofílico, e outra com sobra de par eletrônico, denominada de nucleófilo ou agente nucleofílico.
REAÇÕES POR RADICAIS LIVRES OU RADICALARES
Adição:
O exemplo mais marcante desse tipo de reação é a adição de HBr em compostos com ligação pi entre carbonos catalisada por peróxidos (Efeito Karasch).
Reação:
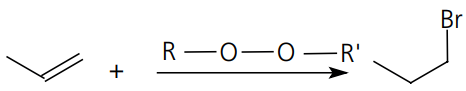
Macanismo:
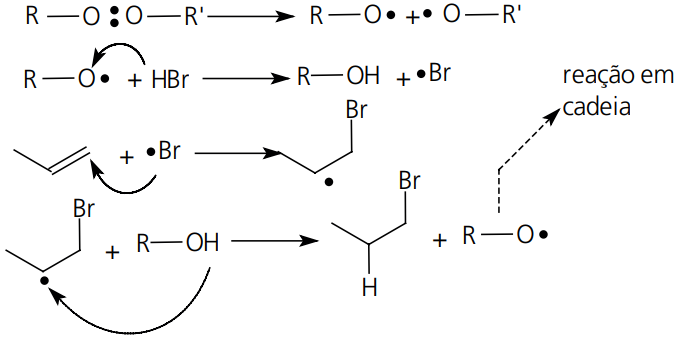
Substituição
O exemplo mais marcante desse tipo de reação é a substituição alifática de halogênios em Alcanos e alquilbenzenos na presença de luz, calor ou peróxidos.
Reação:
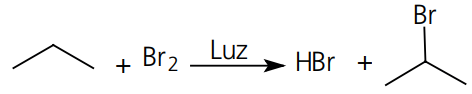
Macanismo:
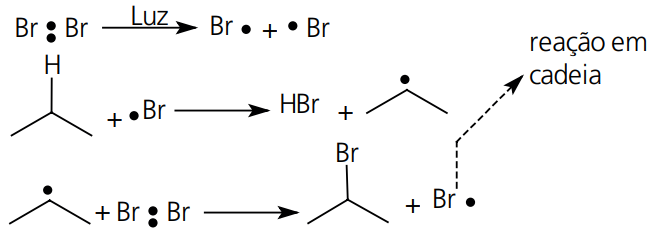
REAÇÕES NÃO RADICALARES
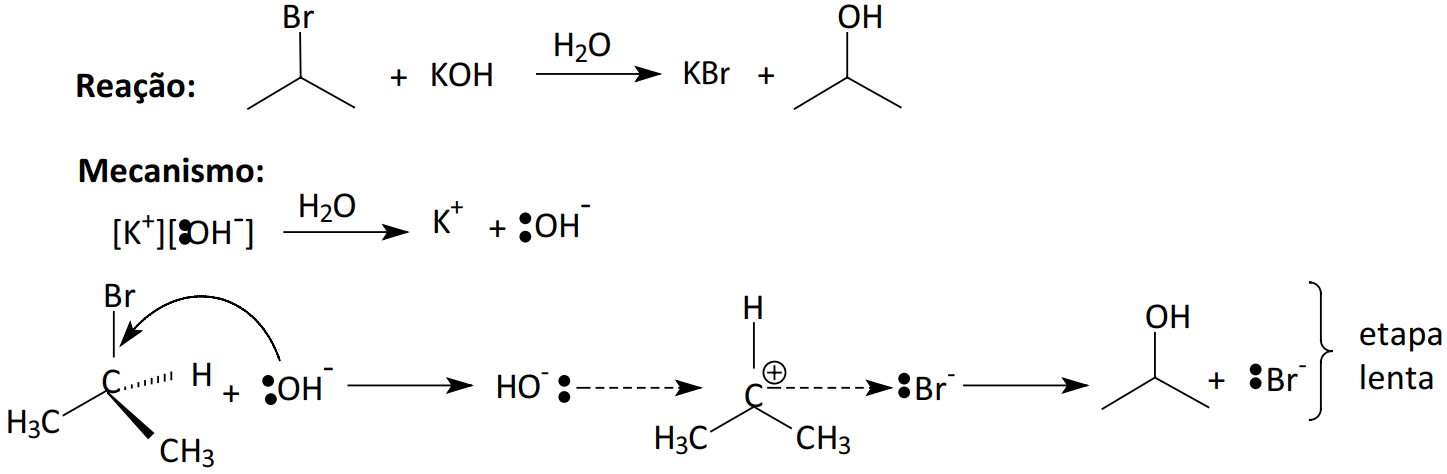
São reações que se caracterizam pela cisão heterolítica da molécula reagente gerando os agentes eletrofílico e nucleofílico. No estudo da Cinética Química, verificamos que uma reação química não elementar apresenta mais de uma etapa e que a expressão matemática da Lei de Velocidade mostra que a velocidade da reação é diretamente proporcional ao produto das concentrações molares dos reagentes da etapa lenta. As reações orgânicas não Radicalares são reações não elementares, elas apresentam normalmente duas etapas, uma lenta e uma rápida. Na etapa lenta os reagentes são divididos em duas classes:
Substrato(S): Molécula orgânica que sofrerá a ação da reação.
Agente (AB): Molécula que poderá sofre uma Heterólise produzindo o eletrófilo, A+ e o nucleófilo, : B–.
Na etapa lenta, A+ ou : B– se liga a molécula do substrato, através da ruptura de ligações químicas, dando formação de uma estrutura intermediária, I.
A etapa rápida é complementar onde o segundo agente, A+ ou : B–, reage com a estrutura intermediária.
Exemplo:
Reação:
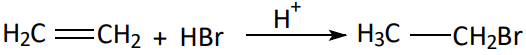
Mecanismo:
Etapa lenta:
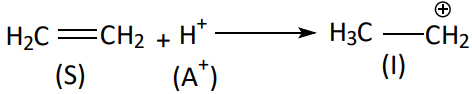
Etapa rápida:
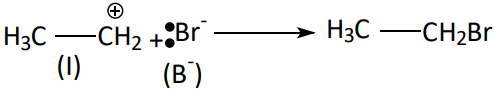
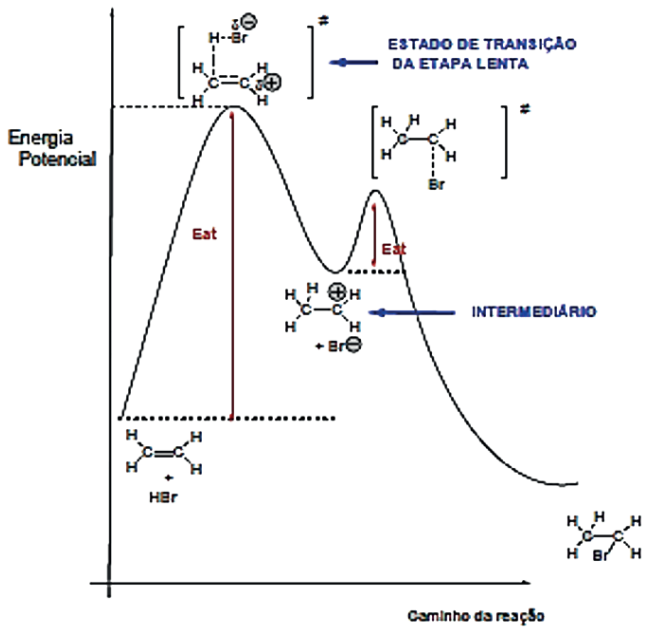
REAÇÕES ELETROFÍLICAS
São reações em que o eletrófilo se liga à molécula orgânica (substrato) na etapa lenta da reação, etapa determinante de Lei de Velocidade da mesma.
Adição: o exemplo mais marcante desse tipo de reação é a adição de moléculas como H2, X2, HX e H2O em compostos com ligação pi entre carbonos, exceto as catalisadas por peróxidos. Nas adições HX e H2O, formamos uma estrutura intermediária, de carga positiva, denominada de íon carbônio ou carbocátion.
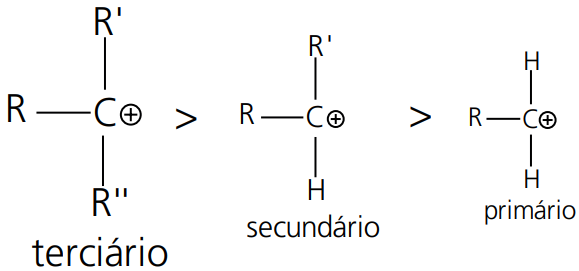
A regra de Markovnikov pode ser esclarecida pela ordem de estabilidade dos carbocátios → (primário < secundário < terciário).
Reação:
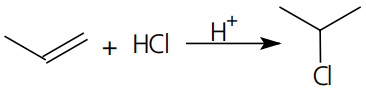
Mecanismo:
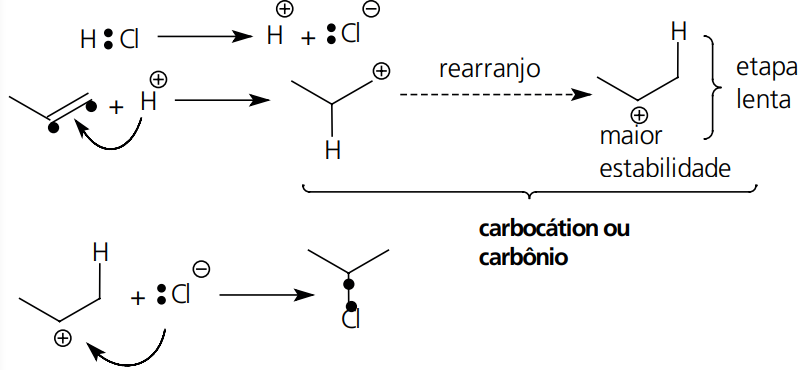
Ordem Relativa de Estabilidade dos Carbocátions:
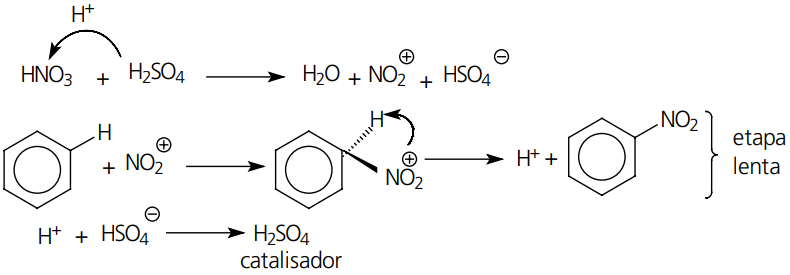
Substituição: o exemplo mais marcante desse tipo de reação é a substituição do átomo de hidrogênio em compostos aromáticos.
Reação:
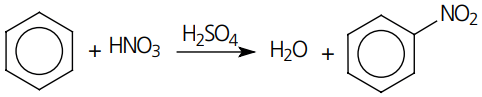
Mecanismo:
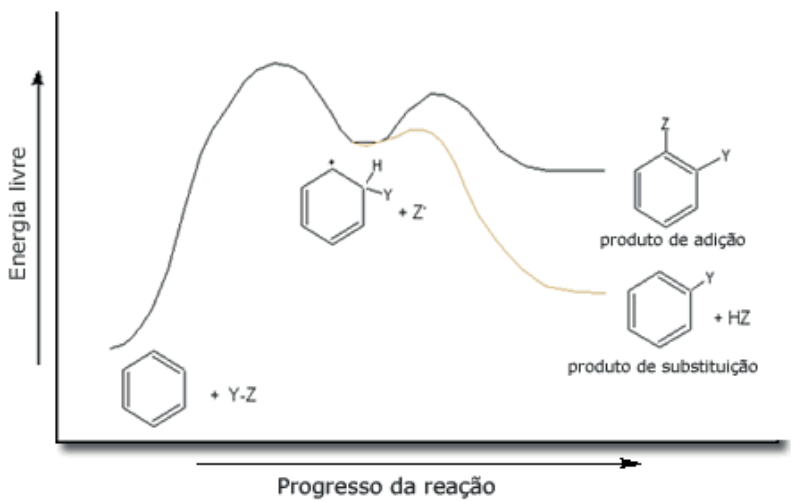
O gráfico procura comparar as duas reações previstas no núcleo benzênico, a adição e a substituição. Observe que o produto da substituição apresenta uma energia menor, logo ele é mais estável.
REAÇÕES NUCLEOFÍLICAS
São reações em o nucleófilo se liga à molécula orgânica (substrato) na etapa lenta da reação, etapa determinante de Lei de Velocidade da mesma.
Adição:
O exemplo mais marcante desse tipo de reação é a adição de moléculas como H2, X2, HX, H2O e RMgX em compostos com ligação pi entre carbono e um átomo de maior eletronegatividade.
Reação:
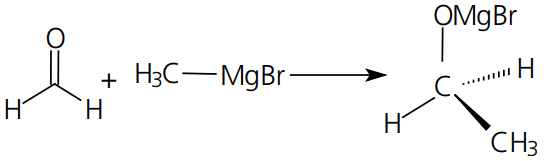
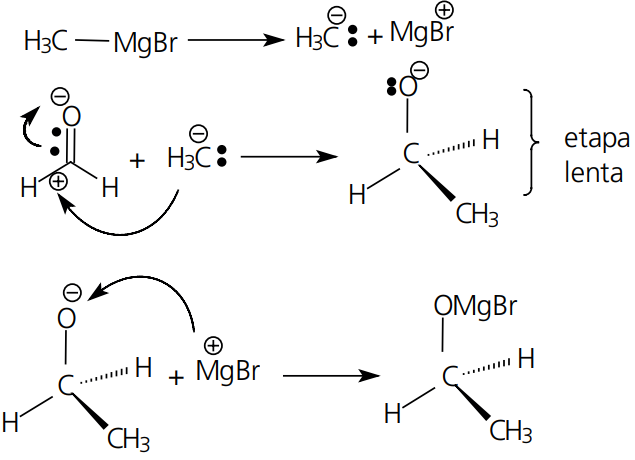
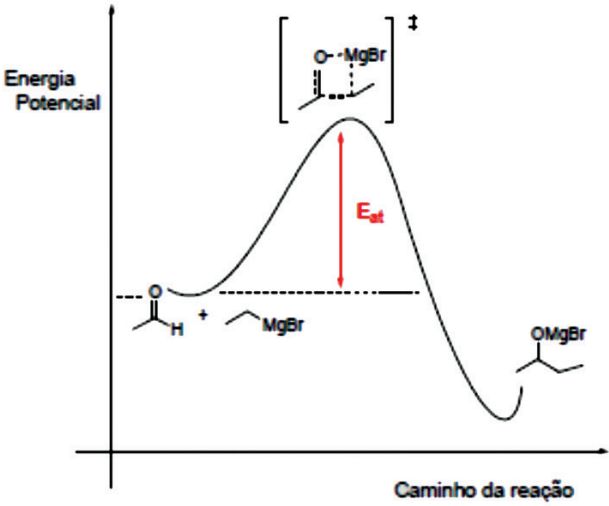
Mecanismo:
Substituição: o exemplo mais marcante desse tipo de reação é a substituição alifática em haletos de alquila e acila.