UNIDADE DE MASSA ATÔMICA (u)
A unidade de massa atômica é atualmente definida como sendo a massa de 1/12 do isótopo 12 do átomo de carbono.
Esquematicamente, temos:
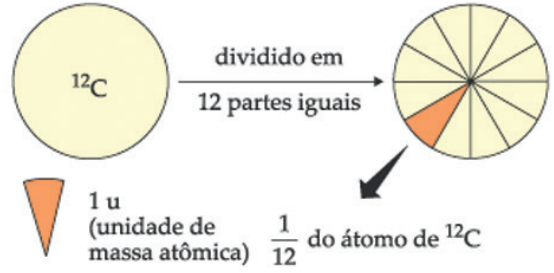
É importante salientar que 1 u é aproximadamente a massa de um próton ou de um nêutron. Veja:
mp = 1,00759 u
mn = 1,00897 u
A partir da definição do padrão, medir as massas dos átomos é simplesmente compará-las com o padrão estabelecido.
A forma atual de medida é baseada em aparelhos denominados espectrômetros de massa.
A Unidade de Massa Atômica (símbolo oficial u ou, não oficialmente, uma) é a unidade estabelecida, internacionalmente, para a medida das massas de partículas, segundo a IUPAC (Internacional Union for Pure and Applied Chemistry).
Exemplos:
He = 4u
Na = 23u
Ca = 40u
*Cℓ = 35,5u
*Cu = 63,5u
Br = 80u
Observação: Você percebe que, nas letras marcadas com asteriscos (*), elementos químicos podem possuir átomos de massas diferentes, chamados de isótopos. É por isso que existe uma diferença entre a massa de um átomo e a massa atômica. A massa de um átomo de um mesmo elemento químico pode variar de acordo com o número de nêutrons nos seus núcleos, mas a massa atômica é uma propriedade do elemento químico e não de seus átomos. Portanto, deve ser, matematicamente, uma média entre seus diferentes isótopos, levando em consideração a ocorrência de cada isótopo.
Exemplos:
01. O elemento químico cloro possui dois isótopos com abundâncias consideráveis na natureza: o isótopo-35 e o isótopo-37, sendo que a porcentagem deste dentre todos os cloros é de 25%. Qual a massa atômica do cloro?
Resolução:
Esquematizando:
M1 = 35u
M2 = 37u
P1 = 75% pois (P1 + P2 = 100%)
P2 = 25%
Usando a média ponderada, temos:
,%20massa%20molecular,%20massa%20molar%20e%20o%20mol/Massa%20atomica%20-%201.png)
02. O elemento químico cobre possui dois isótopos na natureza: o cobre-63 e o cobre-65. Sua massa atômica é de 63,5u. Quais as porcentagens de cada isótopo na natureza?
Resolução:
Esquematizando:
M1 = 63u
M2 = 65u
MA = 63,5u
P1 = ?
P2 = ?
Usando a média ponderada, temos:
,%20massa%20molecular,%20massa%20molar%20e%20o%20mol/Massa%20atomica%20-%202.png)
Lembrando que P1 + P2 = 100% (1),
,%20massa%20molecular,%20massa%20molar%20e%20o%20mol/Massa%20atomica%20-%203.png)
Substituindo (1) em (2),
,%20massa%20molecular,%20massa%20molar%20e%20o%20mol/Massa%20atomica%20-%204.png)
Substituindo em (1), P1 = 75%.
Logo, a porcentagem de cobre-63 é de 75% e do cobre-65 é de 25%.
Observação: É importante salientar que as abundâncias dos isótopos de cada elemento na natureza é constante, ou seja, a mesma em qualquer ponto do planeta.
MASSA MOLECULAR
A massa de uma molécula é a soma das massas atômicas de todos os átomos que constituem esta molécula. Analise os exemplos, consultando a tabela de massas atômicas:
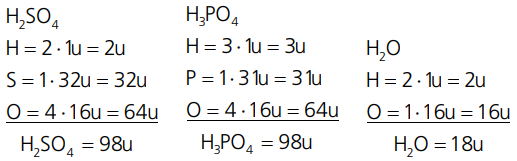
Sendo assim, vamos determinar a massa molecular da água (H2O). Dados: MAH = 1u; MAo = 16u
,%20massa%20molecular,%20massa%20molar%20e%20o%20mol/Massa%20atomica%20-%205.png)
Ou seja, uma molécula de H2O é 18 vezes mais pesada que 1/12 da massa do 12C.
Observação:
A expressão massa molecular é usada para expressar a massa de uma molécula, o que não é apropriado quando se trata das substâncias não moleculares. Para substâncias não moleculares é mais adequado usar a expressão massa-fórmula (MF).
A IUPAC adota oficialmente as expressões massa atômica, massa molecular e massa-fórmula e condena as expressões “peso atômico”, “peso molecular” e “peso-fórmula”.
MASSA MOLAR E O MOL
Mol é dado como um padrão que definimos como sendo a quantidade de átomos de 12C contida em uma amostra de 12 g do mesmo, em outras palavras:
“MoI (cujo símbolo é mol) é a quantidade de substância que possui um número de partículas igual ao número de átomos presentes em 0,012 kg (12 g) do isótopo 12 do carbono”.
O valor numérico de um moI é denominado constante de Avogadro. É uma das constantes físicas conhecidas com maior precisão.
1mol ⇒ 6,02×1023 partículas
Massa molar é a massa em gramas de 1 mol (ou 6,0 · 1023) de partículas. É expressa nas unidades gramas/mol. Inicialmente, vamos nos concentrar em massa molar de elementos e substâncias.
Observação:
a) Quando tratamos de um elemento, a massa molar é numericamente igual à massa atômica, mas expressa em gramas por moI.
Para o elemento oxigênio (MA = 16u), a massa molar é 16 g/mol. Isto nos permite representar:
,%20massa%20molecular,%20massa%20molar%20e%20o%20mol/Massa%20atomica%20-%206.png)
b) Quando nos referimos a uma substância, a massa molar é numericamente igual à massa molecular (ou à massa-fórmula), mas expressa em gramas por moI.
Para a substância água, a massa molecular é: MM = 16u + 2·1u = 18u. A massa molar será 18 g/mol. Isto significa que:
,%20massa%20molecular,%20massa%20molar%20e%20o%20mol/Massa%20atomica%20-%207.png)
Número de mols (n) → é o número de mols contido em uma certa massa de uma substância.
Exemplos:
,%20massa%20molecular,%20massa%20molar%20e%20o%20mol/Massa%20atomica%20-%208.png)
Até aqui, por conveniência numérica, nossos cálculos foram feitos baseados nas massas relativas dos átomos e moléculas.
Gostaríamos, a partir daqui, de ir um pouco além e mostrar que é possível calcular a massa em gramas de um único átomo ou uma única molécula. Vamos tomar como exemplo amostras de três elementos diferentes: sódio, alumínio e cálcio.
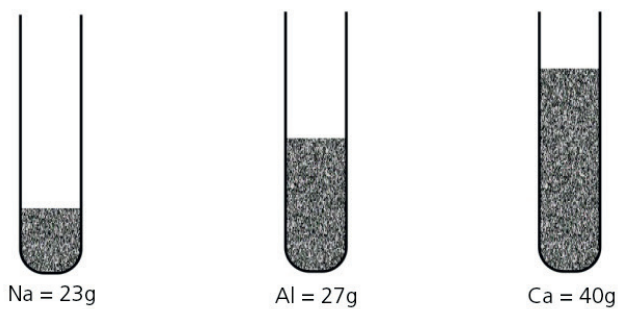
As três amostras, além de possuírem massas diferentes, aparentemente não têm a menor semelhança entre si. Suas massas atômicas também são completamente diferentes, logo, quantos átomos temos em cada situação?




