Os átomos dos demais elementos químicos, em geral, atraem-se não só entre eles, como também com átomos de outros elementos, formando agregados iônicos, moléculas e compostos em geral suficientemente estáveis, que constituem as substâncias simples e/ou compostas. Assim, por exemplo, não existem sódio (Na) nem cloro (C𝓁) livres na natureza; no entanto, existem grandes quantidades de sal de cozinha, como é chamado usualmente (NaC𝓁), em que o sódio e o cloro aparecem unidos entre si.
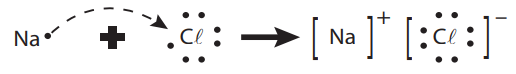
As forças que mantêm os átomos unidos são fundamentalmente de natureza elétrica e são responsáveis por ligações químicas.
Dos elementos químicos conhecidos, pouquíssimos são os que se encontram no estado atômico isolado. Em outras palavras, poucos são os átomos que não se encontram ligados a outros átomos.
Existe uma grande diferença de propriedades entre os materiais que conhecemos e, em grande parte, isto se deve às ligações existentes entre os átomos (Ligações Interatômicas) e a arrumação espacial que passa a existir entre os mesmos.
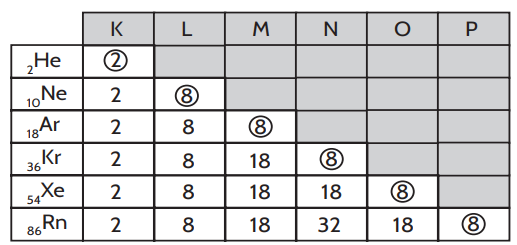
Entre os átomos estáveis, isoladamente, estão os gases nobres (He, Ne, Ar, Kr, Xe e Rn).
Verificando-se as configurações eletrônicas dos átomos desses elementos, observa-se que o que as diferenciam de qualquer outro elemento conhecido é que todas elas apresentam a última camada completa.
AS LIGAÇÕES EM SI
Podemos observar, em função do que foi dito, que cientistas como Kossel e Lewis raciocinaram da seguinte forma:
Por que esses átomos (gases nobres) permanecem no estado isolado? Porque já são estáveis.
Ora, nenhum outro átomo dos elementos conhecidos apresenta “última camada completa”. Nenhum outro átomo dos elementos conhecidos apresenta estabilidade no estado isolado.
Então, os mesmos devem se ligar para alcançar estabilidade.
A REGRA OU TEORIA DO OCTETO
Esse raciocínio leva no século XIX aos mesmos cientistas citados à criação da Teoria do Octeto, o que gera a teoria eletrônica da valência.
“Os átomos ligam-se para adquirir configuração estável, geralmente com oito elétrons na última camada, semelhante a do gás nobre mais próximo.”
É chamada Teoria do Octeto porque, com exceção do hélio (camada K), todos os outros gases nobres completam suas últimas camadas com oito elétrons.
Essa teoria, embora não englobe todos os casos de ligação química hoje conhecidos, como vamos ver, é de um auxílio inestimável ao tratamento elementar do assunto.
A LIGAÇÃO QUÍMICA INTERATÔMICA
As ligações entre átomos são feitas de várias formas, mas sempre envolvendo a camada mais externa (camada de valência), levando os átomos a adquirirem uma forma mais estável. Isso indica que são os elétrons do último nível que participam das ligações.
As ligações são classificadas como:
- Ligação Iônica
- Ligação Covalente (simples/dativa)
- Ligação Metálica