BREVE HISTÓRICO
É o ramo da Química que estuda os compostos do elemento carbono.
O marco fundamental que nos leva a definir a Química Orgânica como hoje, aconteceu em 1828 quando Friedrich Wöhler conseguiu produzir a ureia, composto orgânico presente na urina dos animais, a partir do cianato de amônio, composto mineral (inorgânico). Essa reação, derrubou a chamada Teoria da Força Vital, onde se acreditava na impossibilidade de se obter um composto orgânico a partir de um composto inorgânico.
OS COMPOSTOS ORGÂNICOS
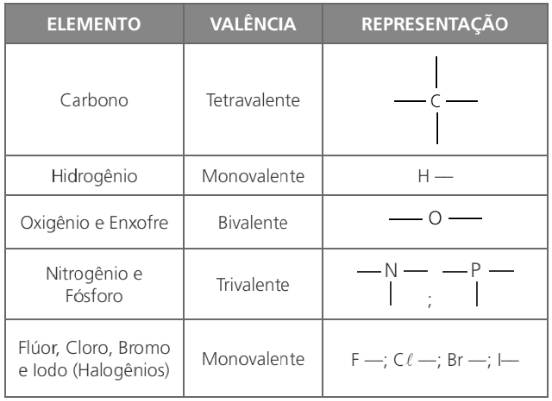
O carbono é o principal elemento formador dos compostos orgânicos. Além dele, são frequentes o hidrogênio, o oxigênio, o nitrogênio, os halogênios como flúor, cloro, bromo e iodo, o enxofre, o fósforo e metais em pequenas quantidades como sódio, potássio, cálcio, etc.
A variedade de compostos em Química Orgânica é tamanha que se faz necessário dividir seus estudos em funções químicas. Com essa divisão é possível prever, de certa forma, as propriedades físicas, a reatividade química e as diversas aplicações desses compostos para uma melhor qualidade de vida dos seres vivos do nosso planeta.
CARACTERÍSTICAS GERAIS
- Encadeamento – os átomos de carbono têm a propriedade de se unir, formando estruturas denominadas cadeias carbônicas.
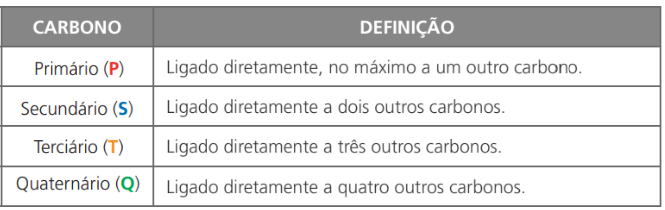
- Classificação do carbono
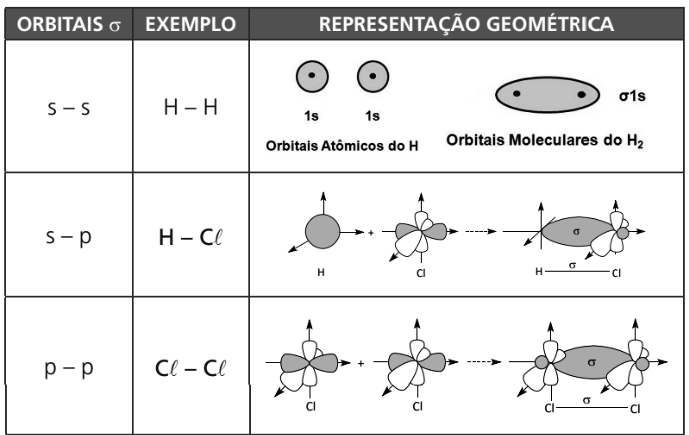
INTERPRETAÇÃO GEOMÉTRICA DOS ORBITAIS – AS LIGAÇÕES SIGMA (𝛔�) E PI (𝛑�)
Orbital molecular ligante: é obtido quando ocorre a ligação química. Sua representação é feita pela superposição de dois orbitais atômicos, já discutidos anteriormente.
Orbital molecular ligante Sigma (σσ)→Superposição frontal de orbitais
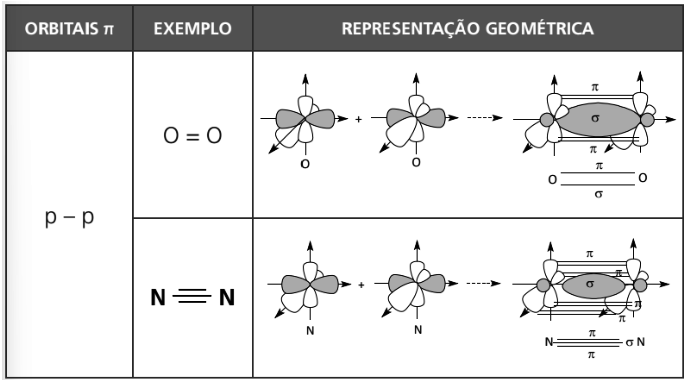
Orbital molecular ligante PI (ππ) → superposição lateral de orbitais.
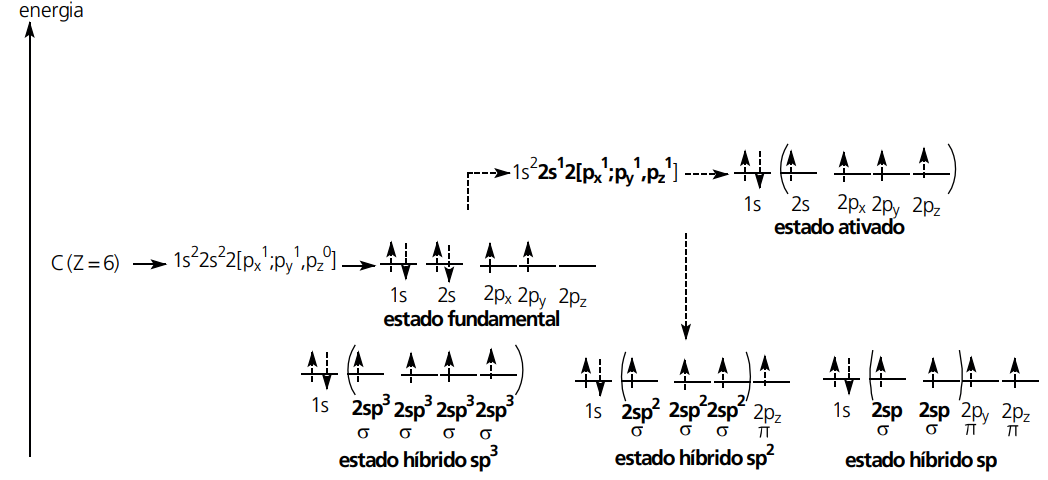
HIBRIDIZAÇÃO (ORBITAIS HÍBRIDOS)
Muitos átomos necessitam misturar os seus orbitais atômicos “puros” para formar orbitais atômicos “híbridos”. Esse fenômeno justifica a existência de diversas moléculas conhecidas.
Para explicar o fenômeno de hibridização, usaremos o exemplo da hibridização do átomo de Berílio (Be) na formação do hidreto de berílio (BeH2). Lembramos que os demais casos exemplificados ocorrerão de forma semelhante.
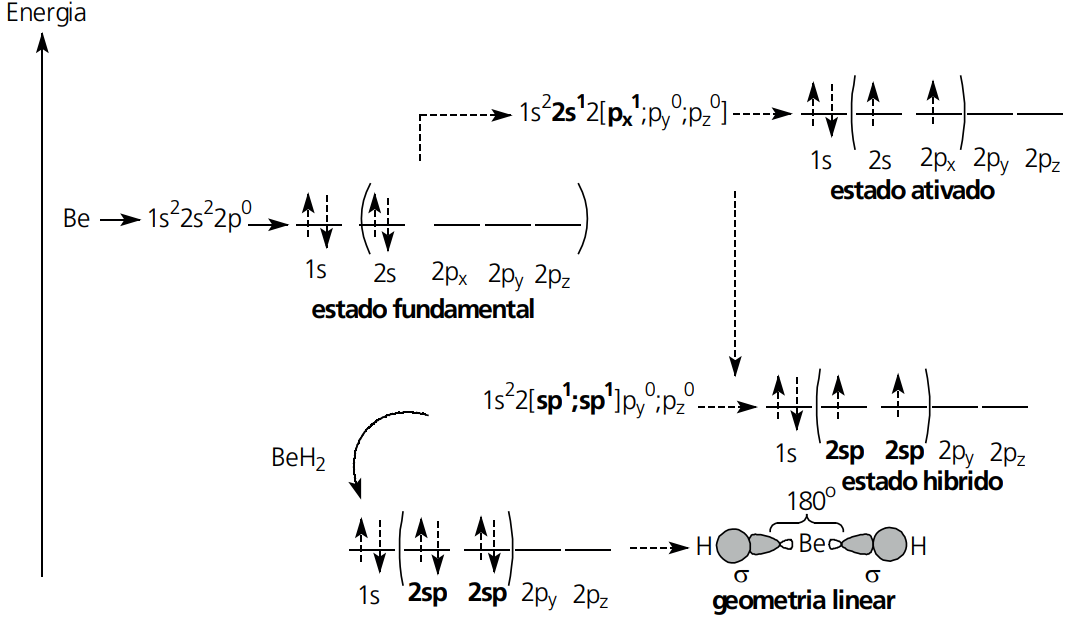
TIPOS DE HIBRIDIZAÇÃO ENVOLVENDO ORBITAIS S E P
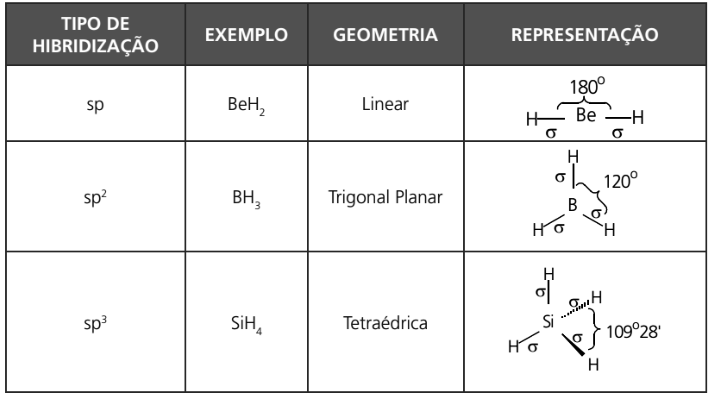
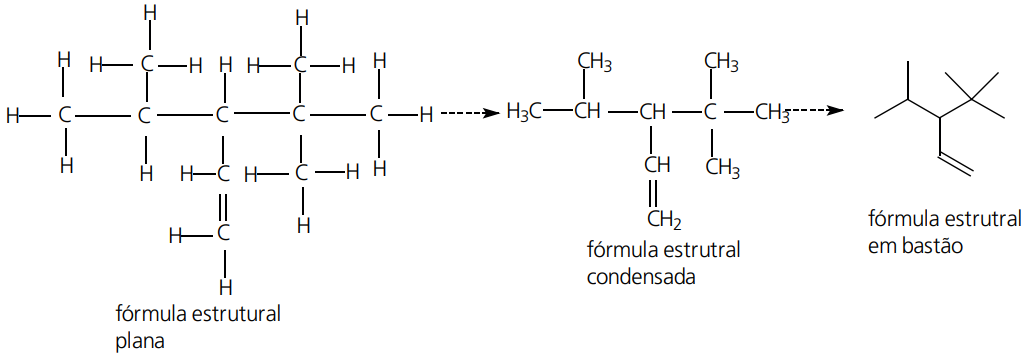
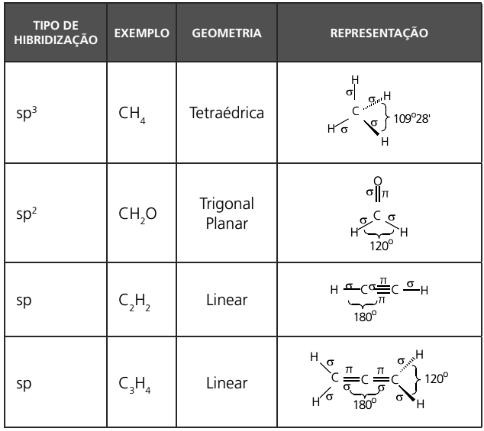
Observação: a seguir encontra-se uma tabela que demonstra a projeção de fórmulas estruturais.
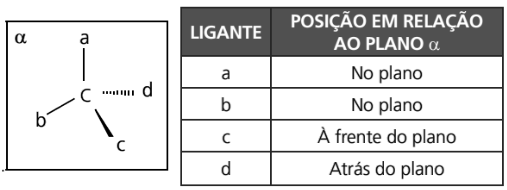
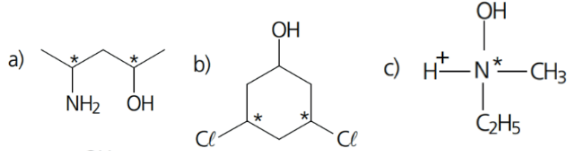
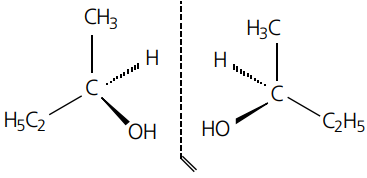
CARBONO QUIRAL OU ASSIMÉTRICO
Apresentam em cada uma de suas quatro ligações grupamentos moleculares diferentes entre si.
TIPOS DE HIBRIDIZAÇÃO ENVOLVENDO ORBITAIS S E P DO ÁTOMO DE CARBONO
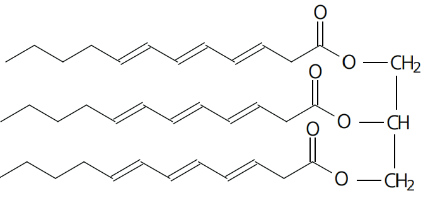
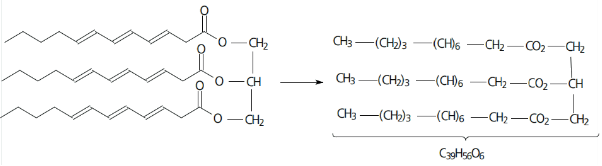
Exemplo 1: escreva as fórmula bruta e condensada para o composto abaixo.
Resolução:
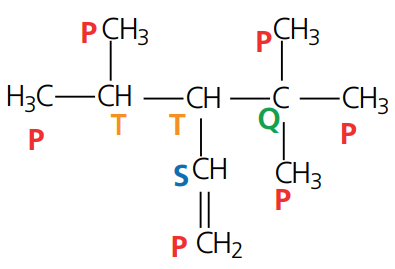
Exemplo 2: determine o número de átomos de carbonos primários, secundários, terciários e quaternários presentes nos compostos abaixo.
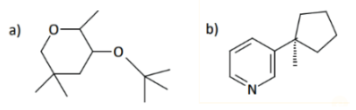
Resolução:
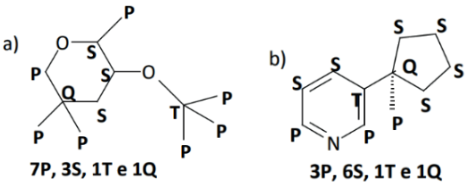
Exemplo 3: determine o tipo de hibridização dos átomos de carbono enumerados nas estruturas abaixo.
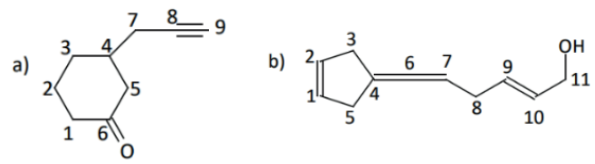
Resolução:
a) sp3 → 1, 2, 3, 4, 5 e 7; sp2 → 6; sp → 8 e 9
b) sp3 → 3, 5, 8 e 11; sp2 → 1, 2, 4, 7, 8, 9 e 10; sp → 6
Exemplo 4: nas estruturas abaixo, identi que os centros quirais presentes usando um asterisco(*):
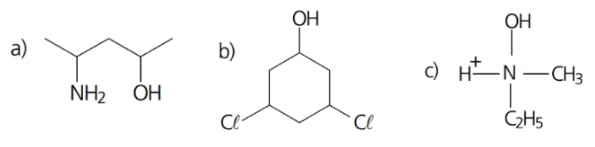
Resolução: