LIGAÇÃO COVALENTE OU MOLECULAR
Em geral, é um tipo de ligação que ocorre entre ametais, ametal e hidrogênio e entre átomos de hidrogênio, com pequena diferença de eletronegatividade entre os elementos.
Exemplo:
a) Molécula H2
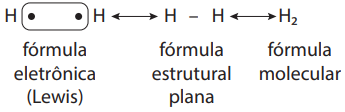
Os átomos de hidrogênio ligam-se através de um par de elétrons, chamado covalente, que passará daí por diante a pertencer a ambos os átomos, satisfazendo, desse modo, suas necessidades eletrônicas. Está formada, assim, uma verdadeira molécula.
b) Gás oxigênio (O2)
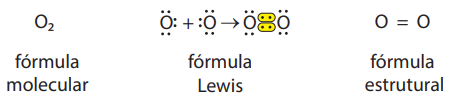
c) Gás nitrogênio (N2)
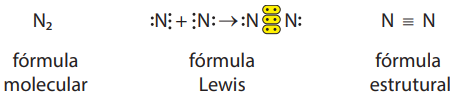
LIGAÇÃO COVALENTE SIMPLES E COVALENTE COORDENADA (OU DATIVA)
LIGAÇÃO COVALENTE SIMPLES OU NORMAL
Quando o par eletrônico é formado por um elétron de cada um dos átomos ligantes.
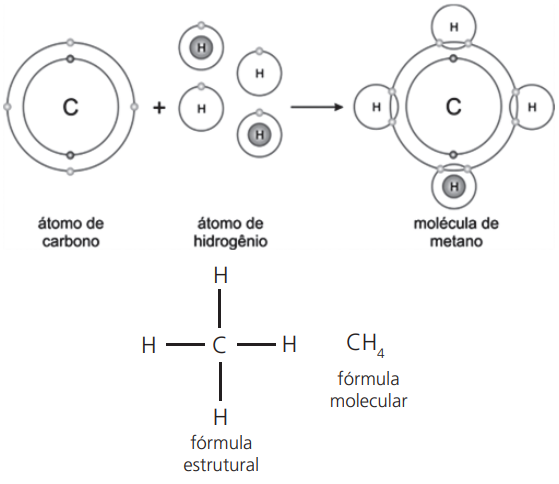
Exemplo:
molécula de metano (CH4)
LIGAÇÃO COVALENTE DATIVA OU COORDENADA
É uma forma de explicar algumas estruturas moleculares que somente a ligação simples não se fazia suficiente, daí a criação de uma teoria da ligação coordenada.
Em geral, ocorre quando os átomos já atingiram a estabilidade (octeto completo) e ainda existem átomos a participar da estrutura formada, então, um dos átomos disponibiliza o par de elétrons para o outro que necessita.
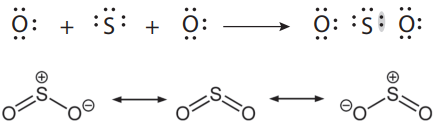
O caso do anidrido sulfúrico (SO3) é semelhante:
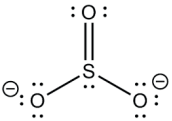
RELAÇÃO ENTRE A TABELA E A LIGAÇÃO COVALENTE
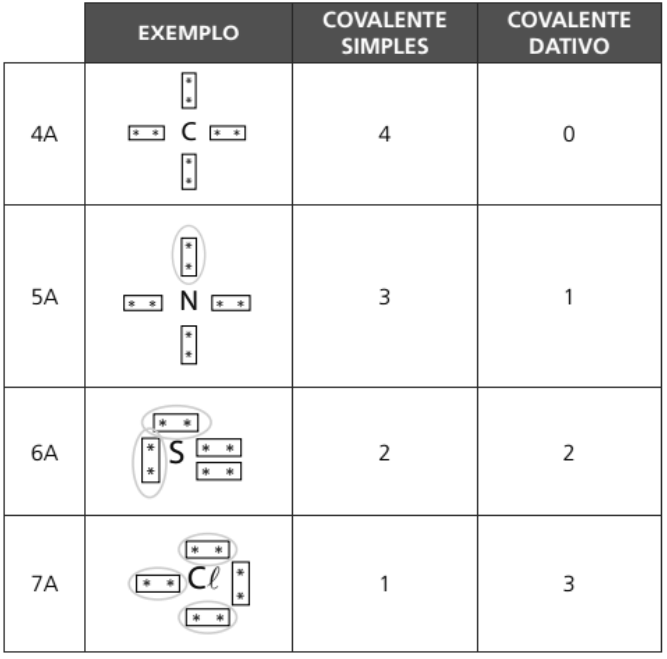
PROPRIEDADE DOS COMPONENTES COVALENTES
1. Os gases e líquidos são, em geral, covalentes em temperatura ambiente.
2. a) Nos sólidos duríssimos, como o diamante, as ligações covalentes são em cadeia.
b) Nos sólidos de baixo ponto de fusão, como o açúcar, a união é entre moléculas devido à sua polaridade.
c) Não conduzem corrente elétrica em estado sólido, nem quando dissolvidos (há exceções, como os ácidos) ou fundidos.
OBSERVAÇÕES
Alguns metais, por apresentarem alta energia de ionização para seus elétrons de valência, podem apresentar ligações covalentes quando combinados com não metais.
Exemplo:
BeC2 (covalente) AℓC3 (covalente)
4Be−1s22s2
13Aℓ−1s22s22p63s23p1
É muito difícil retirar 2 elétrons do berílio ou 3 elétrons do alumínio: isto requer alta energia.
Vamos aplicar essa teoria para a molécula biatômica mais simples que conhecemos, H2.
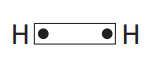
Esse par eletrônico é constituído pela união dos orbitais s.
O compartilhamento do par eletrônico consiste, em última análise, no fato de existirem dois elétrons sendo atraídos simultaneamente por dois núcleos.
Nesse sentido, podemos conceituar orbital molecular como a região mais provável para localizarmos o par eletrônico da ligação covalente.
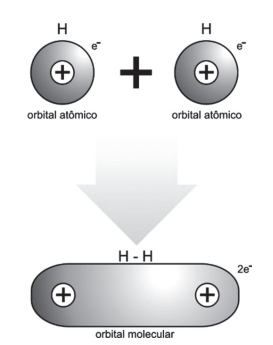
Observação:
EXCEÇÕES À REGRA DO OCTETO
Hoje são conhecidos compostos que não obedecem ao modelo do octeto.
- Em alguns casos, as ligações se completam com menos de 8 elétrons. Isso acontece com o berílio (Be) e o boro (B), que, em certas moléculas, não apresenta o octeto completo.
Exemplos:

- Em outros casos, as ligações perfazem mais do que 8 elétrons. Ocorre geralmente com o fósforo (P) e o enxofre (S), que, em certas moléculas, aparecem com 10 e 12 elétrons na camada de valência.
Exemplo:





