LIGAÇÃO IÔNICA OU ELETROVALENTE
Em geral, ocorre entre metais e ametais, levando à formação de íons.
Exemplo:
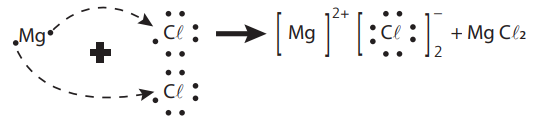
Observação:
ÍONS são átomos ou grupo de átomos carregados eletricamente.
Quando o íon é positivo, é chamado cátion.
Quando o íon é negativo, é chamado ânion.

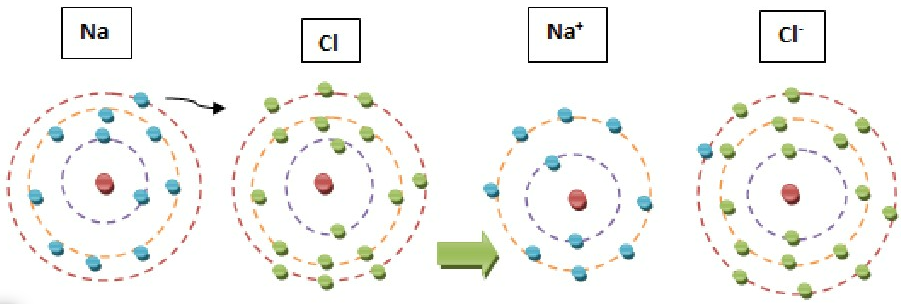
a) Na+ e C𝓁– são chamados ÍONS.
b) Os íons Na+ e C𝓁– possuem 8 elétrons na última camada. Obedecem, portanto, à Teoria do Octeto.
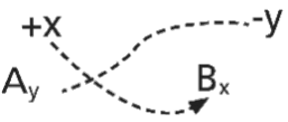
De uma forma geral, temos que: (formulação dos compostos iônicos).
O RETÍCULO CRISTALINO DO CLORETO DE SÓDIO
A fórmula Na+Cℓ– ou NaCℓ indica a proporção com que os íons participam do retículo cristalino, nesse caso 1 : 1.
Observe que, para a ligação, houve transferência de elétrons, através da qual as configurações eletrônicas atingiram a estrutura estável.
Os cátions sódio ligam-se por forças de natureza eletrostática aos ânions cloreto, na proporção de 1 : 1 e temos, então, a formação de uma substância iônica, o cloreto de sódio.
As forças interiônicas são muito intensas; por isso, as substâncias formadas através dessas ligações são sólidas.
Esses sólidos são resultados da disposição geométrica uniforme dos íons nos chamados retículos cristalinos.
A seguir temos um exemplo mostrando uma pequena parte de um cristal de cloreto de sódio, que forma um retículo chamado cúbico de face centrada.

Observação: A estabilidade das substâncias iônicas deve-se à libertação de uma grande quantidade de energia, denominada energia reticular, ao formar-se o sólido iônico.
RELAÇÃO ENTRE A TABELA E A LIGAÇÃO IÔNICA
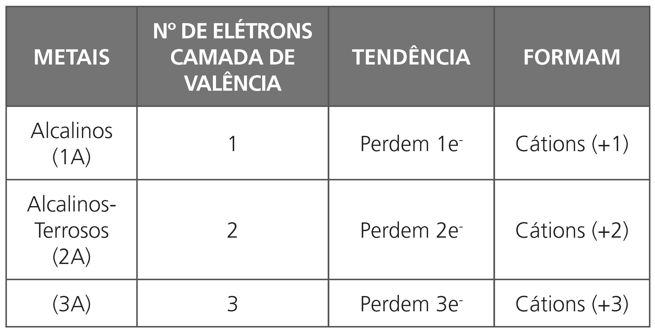
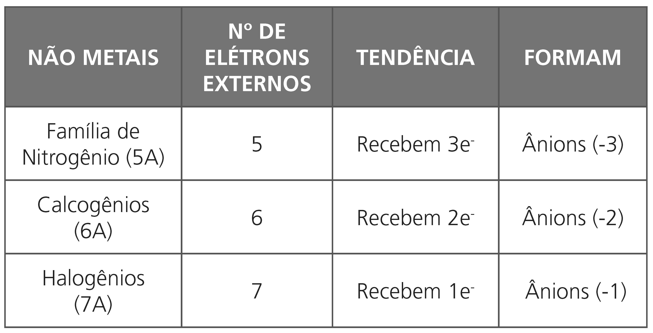
Observação:
- O cátion deve ser escrito do lado esquerdo da fórmula.
- Toda fórmula iônica é neutra, isto é, a carga total positiva e a total negativa são sempre numericamente iguais.

- Alguns metais podem apresentar várias cargas, ou seja, formar vários cátions (números variantes).

PROPRIEDADES DOS COMPOSTOS IÔNICOS
- Apresentam alto ponto de fusão e alto ponto de ebulição.
- NaCℓ (P.F. = 801 °C; P.E. = 1413 °C).
- Todos são sólidos em condições ambiente (25 °C, 1 atm), apresentando RETÍCULOS CRISTALINOS.
- São duros e quebradiços.
- Conduzem corrente elétrica quando fundidos ou em soluções aquosas.
- Como regra geral, são solúveis em solventes fortemente polares e insolúveis em solventes apolares (ou fracamente polares).
NaCℓ é solúvel em H2O (polar)
NaCℓ é insolúvel em Benzeno (apolar)




