O que destaca nesse momento é o uso do Método Científico, baseado na leitura de instrumentos de medida como, por exemplo, a balança, para estabelecer relações dos valores encontrados, o que antes não acontecia.
LEIS PONDERAIS
Neste capítulo, abordaremos as leis de Lavoisier e Proust, utilizando a ideia de mol, que não era conhecida na época de suas publicações.
LEI DE LAVOISIER OU LEI DA CONSERVAÇÃO DA MATÉRIA OU DAS MASSAS
“Num sistema fechado em que possa ocorrer uma transformação química, a massa total do sistema permanece constante durante toda a ocorrência da respectiva transformação.”
Exemplo:
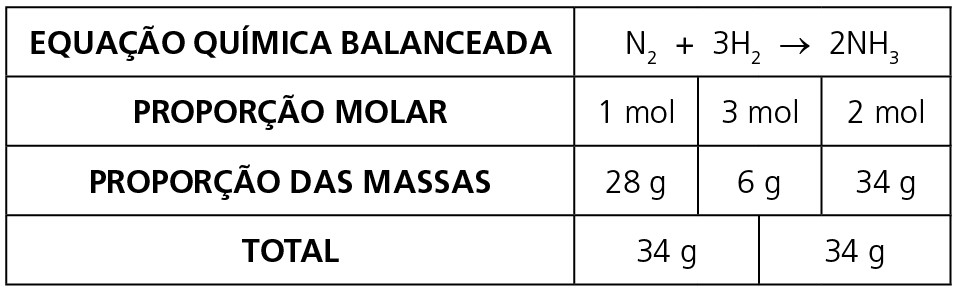
LEI DE PROUST OU LEI DAS PROPORÇÕES DEFINIDAS
“As massas dos elementos químicos que participam da composição de uma substância pura obedecem a uma proporção constante e dada por números inteiros e pequenos”.
Exemplo:
Na reação, N2 + 3H2 → 2NH3, do exemplo anterior, observamos que as substâncias N2, H2 e NH3 obedecem a uma proporção de massa dada por 28 g : 6 g : 34 g. Essa proporção pode ser simplificada para 14 g : 3 g : 17 g.
Podemos, assim, escrever essa proporção pela seguinte relação:

LEI DE DALTON OU LEI DAS PROPORÇÕES MÚLTIPLAS
Quando duas substâncias simples reagem entre si para formar compostos diferentes, se a massa de uma delas permanecer fixa, a da outra irá variar numa relação de números inteiros e pequenos.
Exemplos:

LEI DE RICHTER, WENZEL E BERZELIUS OU LEI DOS EQUIVALENTES QUÍMICOS
Quando uma massa fixa de uma substância reage totalmente com determinadas massas de substâncias diferentes, se estas reagirem entre si, o farão na mesma relação de massas com que reagiram com a primeira ou, então, com valores múltiplos ou submúltiplos destes.
Exemplos:

UMA IMPORTANTE CONSEQUÊNCIA DA LEI DE PROUST
CÁLCULO DE FÓRMULAS
Fórmula ou Composição Centesimal
Expressa a fórmula de uma substância em termos das porcentagens em massa de seus elementos.
Fórmula Mínima ou Empírica
Expressa a fórmula de uma substância em termos da menor proporção inteira entre os números de mols de átomos do elemento na substância.
Fórmula Bruta ou Molecular
Expressa a fórmula de uma substância em termos da menor proporção inteira entre os números de mols de átomos do elemento na substância de forma que o somatório de suas massas seja numericamente igual à massa molar da substância.
LEIS VOLUMÉTRICAS
LEI VOLUMÉTRICA DE GAY LUSSAC – LEI DAS PROPORÇÕES GASOSAS
“Numa reação química que apresenta, pelo menos, duas substâncias gasosas nas mesmas condições de temperatura e pressão, a proporção entre os seus volumes será igual à proporção entre as suas quantidades de moléculas (número de mols).
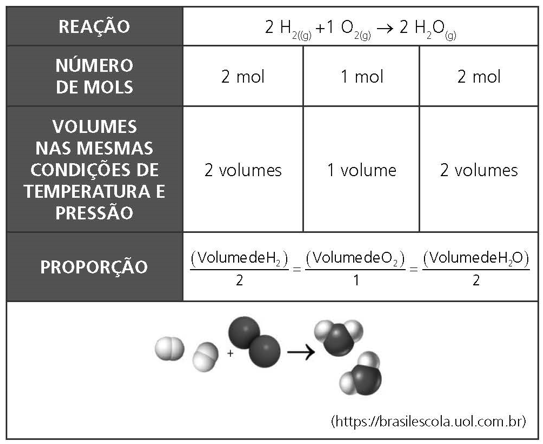
Observação: Se essa reação ocorrer em um recipiente de volume variável, como um balão de borracha, por exemplo, vamos observar uma contração de volume, ou seja, o balão irá murchar.
LEI DE AVOGADRO
“Dois gases, quando colocados em recipientes de igual volume e nas mesmas condições de temperatura e pressão, apresentarão o mesmo número de moléculas em seus recipientes.”




