FÓRMULA MÍNIMA, FÓRMULA MOLECULAR E FÓRMULA CENTESIMAL (PERCENTUAL)
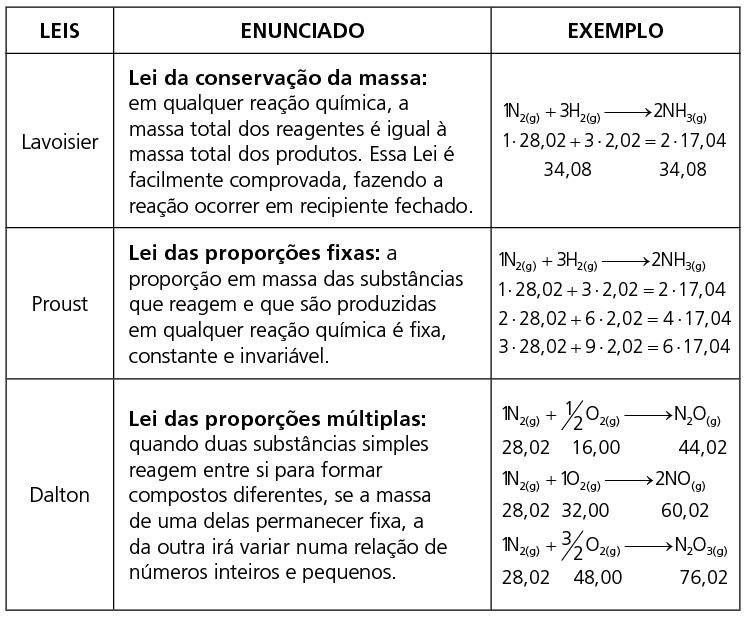
A fórmula mínima (ou empírica) de uma substância indica a proporção atômica de combinação dos elementos através de números inteiros mais simples possíveis (números primos entre si).
A fórmula molecular (ou bruta) de uma substância indica o número de átomos de cada elemento que compõe a molécula. Consequentemente, a fórmula molecular é um múltiplo da fórmula mínima: FM=(fm)n.
Em que:

A fórmula percentual (centesimal) é a que indica os átomos de uma molécula através de suas percentagens em massa.
Exemplo:
DETERMINAÇÃO DA FÓRMULA MÍNIMA DE UMA SUBSTÂNCIA
Assim que uma substância nova é descoberta, ela é submetida à análise, que determina seus elementos químicos constituintes e suas respectivas porcentagens.
Com base nessas porcentagens e nas massas atômicas dos elementos, chega-se à proporção atômica de combinação entre os elementos químicos, que é a fórmula mínima da substância.
Exemplo:
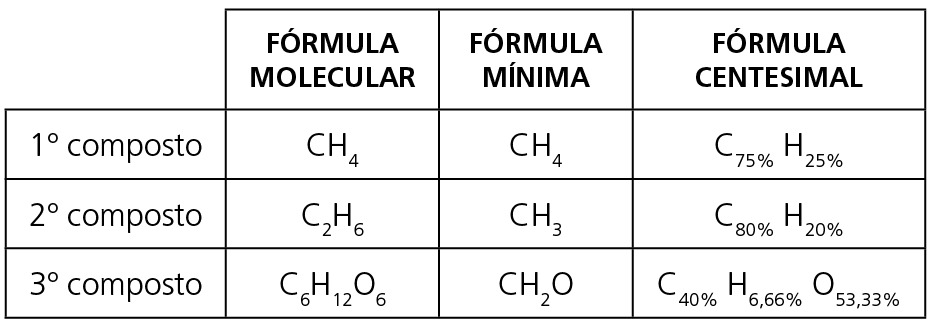
Na análise de certa massa de um composto, foram encontrados 8 g de cálcio, 6,2 g de fósforo e 11,2 g de oxigênio. Vamos determinar sua fórmula mínima, sabendo que Ca = 40u, P = 31u e O =16u.
Temos:

(proporção em mols de átomos ou proporção em átomos).
Para transformar os números decimais em números inteiros, podemos multiplicar todos por 10, resultando 2 : 2 : 7. Então, a fórmula mínima do composto é Ca2P2O7 (pirofosfato de cálcio).
Observação:
- Geralmente, para se obter a proporção de números inteiros, o artifício matemático mais usado é a divisão dos números pelo menor deles. Assim, nesse caso, temos:

- A seguir, multiplicamos todos os números obtidos por 2, resultando a proporção de números inteiros 2 : 2 : 7. Se, na divisão pelo menor, resultassem números decimais do tipo 2,3; 3,7 etc., deveríamos multiplicar todos por 3 e arredondá-los (permite-se um arredondamento de até 0,1, pois esse valor está dentro dos erros experimentais).
- Como os compostos iônicos não possuem moléculas, eles são representados pelas respectivas fórmulas mínimas. Assim, por exemplo, temos Ca2P2O7 (pirofosfato de cálcio), Na2SO4 (sulfato de sódio) e Mg(NO3)2 (nitrato de magnésio). São exceções os sais mercurosos ou de mercúrio (I): Hg2, Cℓ2, Hg2 (NO3)2 etc.
DETERMINAÇÃO DA FÓRMULA PERCENTUAL DE UMA SUBSTÂNCIA
Exemplos:
01. Qual a fórmula centesimal do composto H2SO4? Dados: H=1; S=32; O=16
Resolução:
Quando se deseja calcular a fórmula centesimal de um composto, deve-se calcular a porcentagem em massa de cada elemento químico na molécula. Para fazer isto de maneira rápida, basta utilizar o resultado obtido na regra de três a seguir:

Fazendo uso da equação (1), temos:
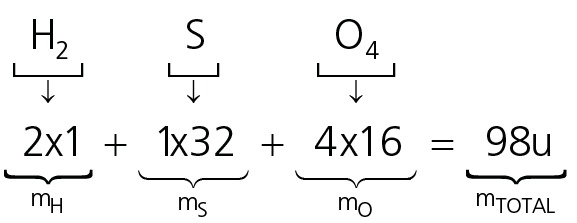

Portanto, a fórmula centesimal de é H2SO4 é H2,04%S32,65%O65,31%.
Note que a soma das porcentagens é 100%. Se o resultado da soma das porcentagens for próximo de 100%, não significa que esteja errado, apenas os arredondamentos não foram compatíveis com o número de casas decimais utilizadas. A experiência mostra que duas casas decimais são suficientes.
02. Qual a fórmula centesimal do composto NaOH?
Dados: Na = 23; O = 16; H = 1
Resolução:
Procedendo como no exemplo anterior, temos:
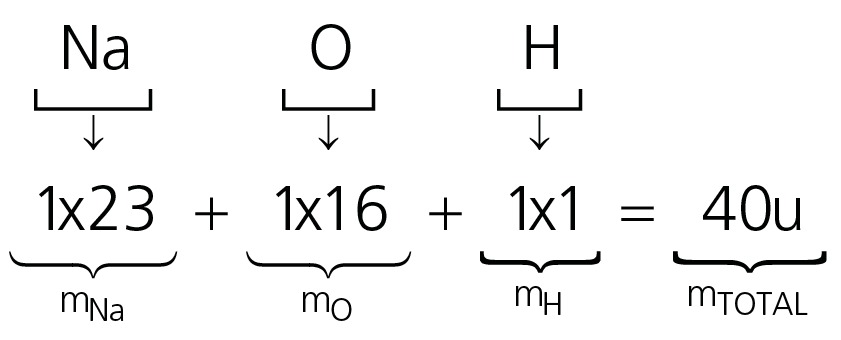

Portanto, a fórmula centesimal do composto é NaOH é Na57,5%O40%H2,5%.
DETERMINAÇÃO DA FÓRMULA MOLECULAR DE UMA SUBSTÂNCIA
03. Qual a fórmula molecular do composto H5,88%O94,12%, sabendo que M = 34 g/mol? Dados: H=1; O=16
Resolução:
Procedendo da mesma forma que no exercício anterior, temos:
Em 100 g do composto
- 5,88 g de H
- 94,12 g de O

Portanto, a fórmula mínima do composto é:
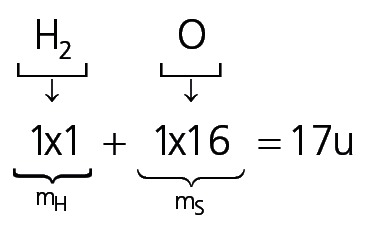
e tem massa de 17u.
Como a massa da fórmula molecular é dada e vale 34u, percebe-se que, para se obter a fórmula mínima a partir da molecular, simplificou-se esta por 2. Portanto, a fórmula molecular do composto é dada por H2O2.
A Química é uma ciência relativamente nova. A maioria dos conceitos que estudamos hoje foram estabelecidos há pouco mais de 200 anos.
Dentre os conceitos mais importantes encontram-se as Leis das Combinações Químicas que expressam regularidades que podem ser observadas experimentalmente.
O precursor dessas leis, Antoine Laurent de Lavoisier, é considerado hoje o “Pai da Química”, pois foi seu método de trabalho (recipientes fechados, uso constante de balança e medidas rigorosas das massas de reagentes e produtos) que deu origem à chamada Química Moderna.
Por meio de suas experiências, Lavoisier descobriu, por exemplo, que a água é uma substância composta, formada de dois elementos, que o gás oxigênio é responsável pelas reações de combustão e que a matéria não pode ser criada nem destruída, apenas transformada.
Foi a partir das experiências de Lavoisier e Proust que Dalton propôs o modelo atômico maciço indivisível e indestrutível que até hoje representa satisfatoriamente o fenômeno das reações químicas demonstrando visualmente as leis relacionadas no quadro a seguir.