Há ainda experiências que permitem calcular a massa molecular da substância, mesmo que ela seja desconhecida (como o cálculo da densidade relativa para gases ou a medida da pressão osmótica para soluções líquidas).
Com essas informações, sustentadas pelas leis ponderais, é possível encontrar as mais variadas fórmulas para uma substância, como, por exemplo: a fórmula mínima, a fórmula molecular ou a fórmula centesimal.
LEIS PONDERAIS
LEI DE LAVOISIER OU LEI DE CONSERVAÇÃO DAS MASSAS
Nos seus estudos experimentais, Lavoisier preocupou-se em determinar a massa total do sistema antes e depois de ocorrer a reação química.
Um dos experimentos realizados por ele mostrou que:
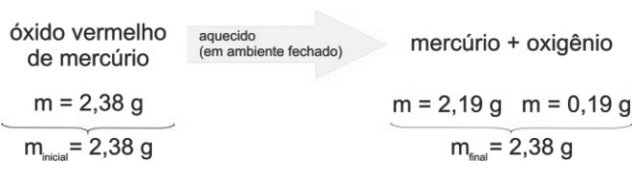
A massa total do sistema antes e depois da reação permaneceu a mesma. Para se formular uma lei, não basta fazer uma única experiência; é necessário realizar um número razoável delas e, então, enunciar as regularidades observadas. Assim, após vários experimentos, Lavoisier pôde enunciar a lei da conservação das massas: em um sistema fechado, a massa dos reagentes é igual à massa dos produtos.
LEI DE PROUST OU LEI DAS PROPORÇÕES CONSTANTES
Quase na mesma época de Lavoisier, Proust realizou inúmeros experimentos concluindo que: uma determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa.
Com base nas regularidades observadas experimentalmente, como, por exemplo:
1ª experiência: 3 g de carbono (C) se unem a 8 g de oxigênio (O2), produzindo 11 g de gás carbônico CO2.
2ª experiência: 6 g de carbono (C) se unem a 16 g de oxigênio (O2), produzindo 22 g de gás carbônico CO2.
Logo, concluímos que uma determinada substância pura, qualquer que seja sua origem, apresenta sempre a mesma composição em massa.
Observação:
Em decorrência desse fato, podemos estabelecer uma nova abordagem a respeito das substâncias puras e das misturas:
- uma substância pura, independentemente de sua origem, apresenta uma composição em massa sempre constante;
- uma mistura apresenta composição variável.




