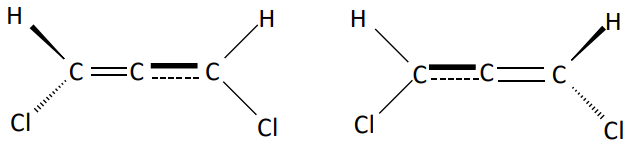
ESTEREOISOMERIA GEOMÉTRICA
Os isômeros apresentam diferentes posições em relação ao plano de simetria molecular.
EM RELAÇÃO À LIGAÇÃO DUPLA ENTRE CARBONOS
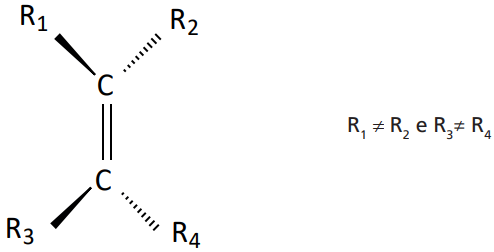
Exemplos:
- Para pelo menos dois radicais coincidentes:
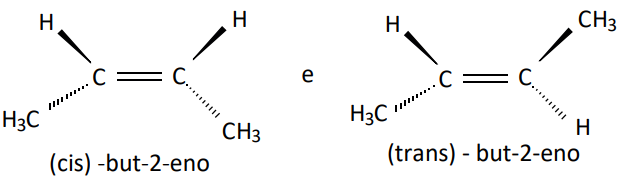
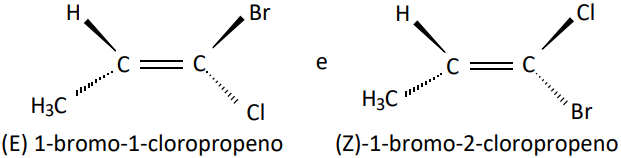
- Para radicais NÃO coincidentes:
EM RELAÇÃO A CARBONOS PERTENCENTES À UMA CADEIA CÍCLICA
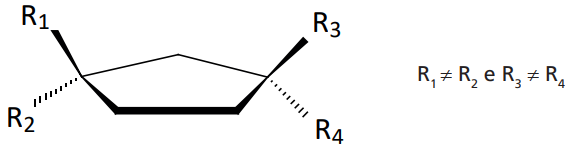
Exemplo:
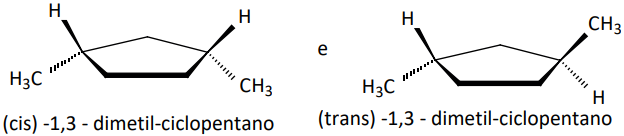
Exercício resolvido: no ambiente marinho, as espécies que se reproduzem por fecundação externa desenvolvem mecanismos químicos para que os gametas masculinos (espermatozoides) e os gametas femininos (oogônios) se reconheçam e se atraiam mutuamente. Nos casos das algas pardas do gênero Fucus, a liberação do oogônio na água é acompanhada da produção de um hidrocarboneto denominado fucosserrateno, que, além de induzir a liberação dos espermatozoides, orienta aqueles que estão nadando sem rumo a nadarem em espiral na direção do oogônio, promovendo a fecundação. Ocorre que o fucosserrateno pode ter seu efeito imitado pelo Hexano, um hidrocarboneto derivado do petróleo. Quando há um vazamento de petróleo no mar, a concentração de Hexano aumenta muito na região, estimulando a emissão de espermatozoides na ausência de oogônios a serem fecundados, o que provoca uma queda significativa na população dessas algas. Esse fato foi observado pela primeira vez em 1960 quando a Fucus desapareceu quase completamente da costa sudoeste da Inglaterra, após o naufrágio de um navio petroleiro.
A partir da fórmula do fucosserrateno:
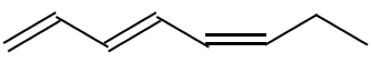
a) Indique o nome IUPAC dessa substância.
b) Com base na numeração dos carbonos na cadeia principal, forneça o número daqueles que apresentam isomeria geométrica.
c) Escreva a fórmula estrutural dos isômeros geométricos do fucosserrateno.
Resolução:
a) oct-1,3,5- trieno
b) Carbonos 3 e 5
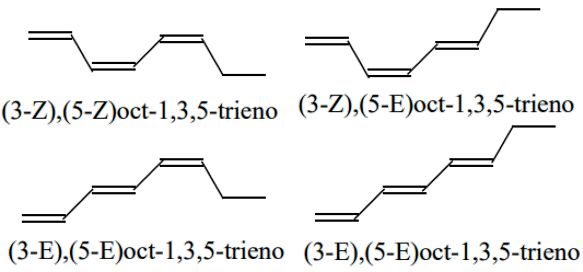
c) O composto apresenta dois sítios estereoisoméricos, logo vai apresentar quatro estereoisômeros.
ESTERIOSOMERIA ÓPTICA
ATIVIDADE ÓPTICA
É quando um determinado composto é capaz de desviar o plano da luz polarizada.
LUZ POLARIZADA
Seus raios luminosos se propagam em uma única direção.
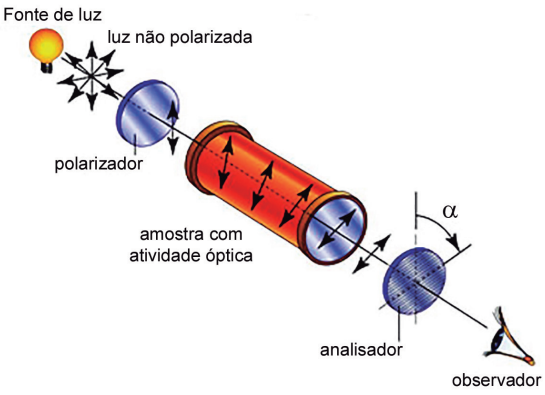
Estruturalmente podemos dizer que as moléculas quirais apresentam atividade óptica podendo originar, no mínimo, os estereoisômeros dextrogiro e levogiro.
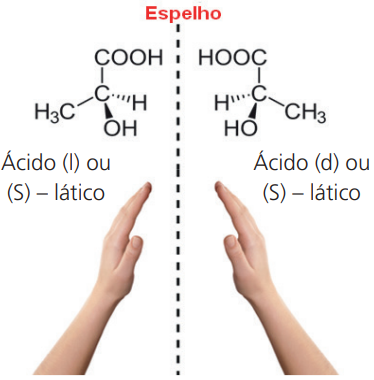
Esses compostos são estruturalmente especulares ou enantiômeros.
Exemplo: ácido lático (2-hidroxi-propanoico)
Exercício resolvido: o ciclo mostrado abaixo ocorre nas mitocôndrias celulares e representa uma etapa muito importante no processo de degradação da glicose.
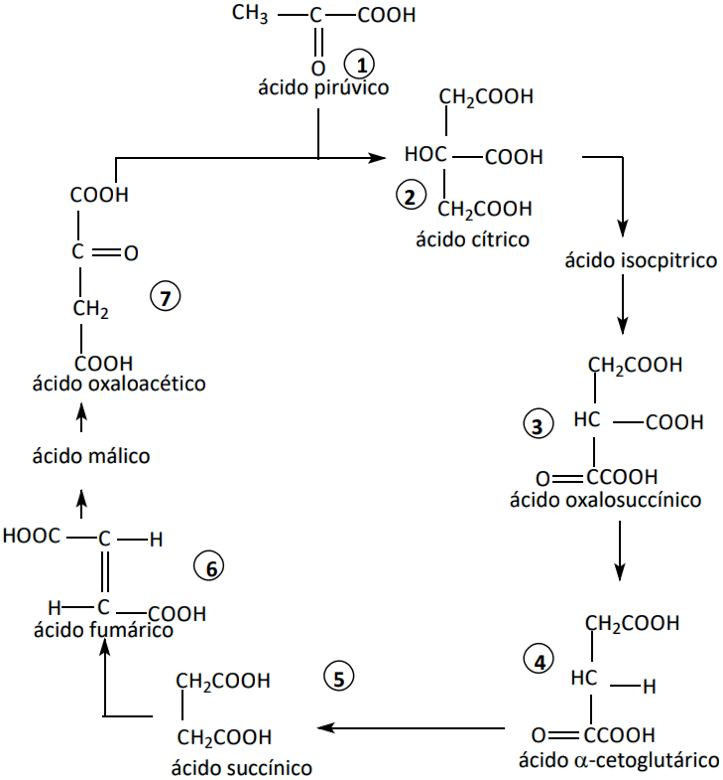
Observe as substâncias numeradas de 1 a 7 e responda:
a) Quais dessas substâncias apresentam isomeria óptica?
b) Quais dessas substâncias apresentam isomeria geométrica? Justifique suas respostas.
Resolução:
a) A substância 3 apresenta isomeria óptica porque possui em sua estrutura um átomo de carbono quiral.
b) A substância 6, pois apresenta ligação dupla e cada átomo de carbono da mesma encontra-se ligado a radicais diferentes.
MISTURA RACÊMICA
Mesmo apresentando centro quiral em sua estrutura, amostras naturais são formadas por uma mistura equimolar entre os estereoisômeros enantiômeros. Essa mistura opticamente inativa é denominada mistura racêmica.
Cálculo do número de estereoisômeros em função do número de centros quirais:
Número de Isômeros Ópticos = 2n
Número de Misturas Racêmicas = 2n-1
Para compostos que apresentam simultaneamente a estereoisomeria geométrica e centros quirais a fórmula 2n serve para o cálculo do número de estereoisômeros, porém n será a soma do número de centros quirais com número de ligações duplas onde se confirma o fenômeno da estereoisomeria geométrica.
DIASTEREOISÔMEROS
São estereoisômeros que não apresentam estruturas especulares, não são enantiômeros. Dividimos os diastereoisômeros e não ativos, como os isômeros geométricos, e os ativos que ocorrem em compostos com dois ou mais centros quirais onde os ligantes de cada centro não sejam coincidentes.
Exemplo:
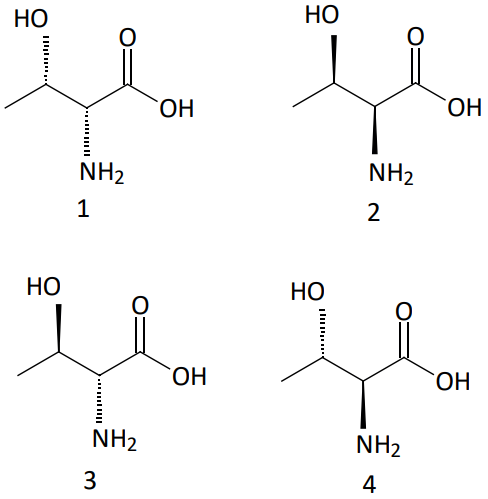
Os isômero 1 é enantiômero de 2 e diasterisômero de 3 e 4, enquanto que 2 é enantiômero de 1 e diasterisômero de 3 e 4.
COMPOSTO MESO OU MESÔMERO
É um estereoisômero inativo e a sua inatividade óptica se atribui a uma compensação interna, pois os centros quirais apresentam ligantes coincidentes.
Exemplos:
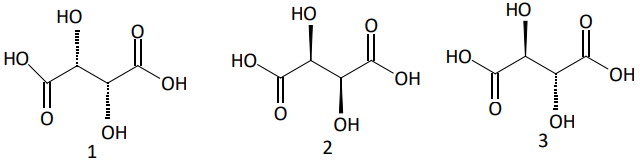
Os estereoisômeros 1 e 2 são ativos e enantiômeros entre si, enquanto que 3 é o estereoisômero meso.
ESTEREOISOMERIA ÓPTICA EM COMPOSTOS CÍCLICOS
Quando um composto cíclico apresenta estereoisomeria geométrica, o seu isômero trans, admite estruturas enantiômeras.
Exemplos:
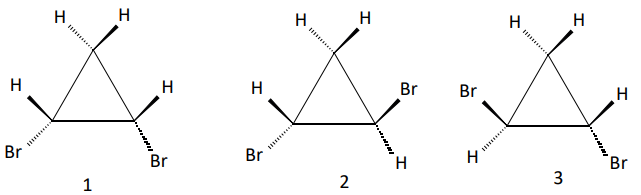
O estereoisômero 1 é cis, 2 e 3, são trans, porém 2 e 3 são especulares não sobreponíveis.
ESTEREOISOMERIA ÓPTICA EM COMPOSTOS ALÊNICOS
O carbono central, de hibridização sp na molécula do propadieno (aleno), apresenta uma geométrica como a figura abaixo:

Como os ligantes dos carbonos laterais, de hibridização sp2 estão em planos perpendiculares, quando cada um desses apresentam ligantes diferentes, é possível descrever estruturas especulares.