ISÓTOPOS
São átomos de mesmo número atômico (mesmo elemento) e números de massa diferentes. A esse fenômeno é dado o nome de isotopia.
Exemplo:

Esses átomos são isótopos entre si, pois observamos que:

O número atômico 8 corresponde ao elemento oxigênio. Portanto, 168O e 188O são dois isótopos do elemento oxigênio.
Nota: mais do que isso são átomos do mesmo elemento, com características semelhantes.
Exemplo:
Para o hidrogênio temos três isótopos:

ISÓBAROS
São átomos de mesmo número de massa e números atômicos diferentes. A esse fenômeno é dado o nome de isobaria.
Exemplos:

ISÓTONOS
São átomos de número de massa e números atômicos diferentes e que apresentam o mesmo número de nêutrons. A esse fenômeno é dado o nome de isotonia.
Exemplos:

Observação:
ESPÉCIES ISOELETRÔNICAS – são as que possuem o mesmo número de elétrons.
Exemplos:

COMPLEMENTOS
- ÁTOMOS ISÓTOPOS E O NÊUTRON
Em 1913, o químico inglês sir Frederick Soddy (1877-1956) e o químico americano Theodore William Richards (1868-1928) descobriram duas massas atômicas diferentes para o chumbo. Quase ao mesmo tempo, Thomson descobriu massas atômicas diferentes para o neônio.
Apesar de terem massas atômicas diferentes, os átomos apresentavam as mesmas propriedades químicas, comprovando serem de um mesmo elemento. Apenas as propriedades físicas que se relacionavam com a massa eram diferentes.
Deu-se a esse fenômeno o nome de isotopia, e aos átomos de um mesmo elemento químico que apresentavam massas atômicas diferentes chamou-se isótopos (do grego iso, mesmo, e tópos, lugar, em referência ao fato de ocuparem o mesmo lugar na tabela periódica).
O fenômeno da isotopia ficou sem explicação até 1932, quando novamente o físico sir James Chadwick solucionou a questão, descobrindo uma nova partícula nuclear, produzida como consequência do bombardeamento de berílio com partículas alfa.
Berílio + partícula α → carbono + nêutron
- QUANDO TEMOS ISÓTOPOS, TEMOS ÁTOMOS QUE APRESENTAM
Propriedades químicas: iguais.
Propriedades físicas: diferentes.
- ABUNDÂNCIA DOS ELEMENTOS
Informações obtidas do estudo da luz emitida pelas estrelas e nebulosas permitem-nos acreditar que o elemento mais abundante no Universo é o hidrogênio – aproximadamente 90% da matéria no Universo é hidrogênio. O seguinte é o hélio. Pensando em termos do nosso planeta, consideraremos aqui aquilo que nos envolve mais diretamente, ou seja, a crosta, os mares e a atmosfera. Analisando os compostos que constituem essas regiões, vamos descobrir que doze elementos constituem mais de 99% em peso da matéria presente, assim distribuídos:
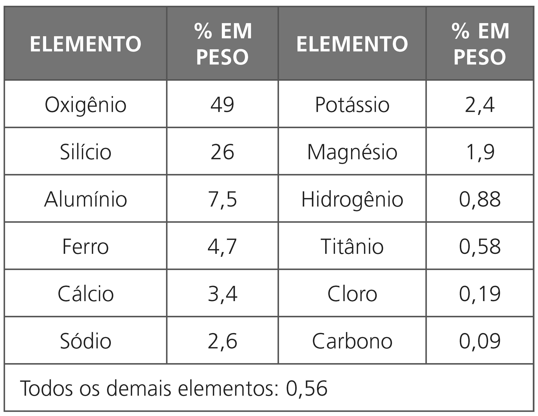
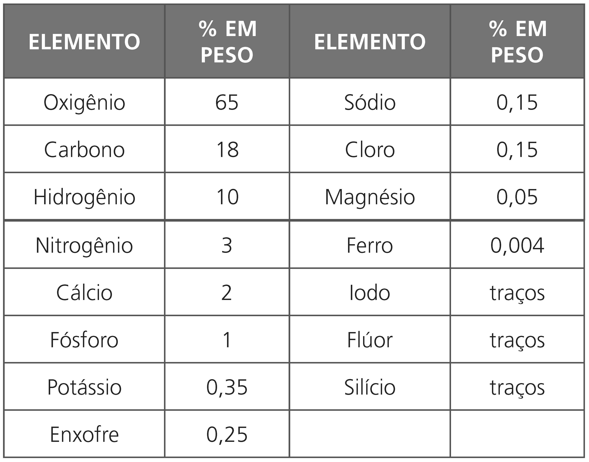
No corpo humano, encontramos uma pequena parcela dos elementos naturais, na proporção que mostra a tabela a seguir:
- Praticamente todos os elementos químicos possuem isótopos, naturais e/ou artificiais (obtidos pelo bombardeamento de núcleos atômicos com partículas aceleradas). Os diferentes isótopos de um elemento são diferenciados pelo número de massa (A), uma vez que possuem o mesmo número de prótons (p), mas diferente número de nêutrons (n).
Os isótopos naturais de um elemento químico são encontrados em proporções praticamente constantes em qualquer amostra desse elemento na natureza.
A massa atômica oficial de cada elemento químico (a que se encontra relacionada na tabela periódica) é a média ponderada das massas atômicas dos isótopos naturais do elemento, multiplicada pela abundância (% em massa) de cada isótopo. Por exemplo: o elemento químico magnésio, Mg, cujo número atômico Z é igual a 12, possui três isótopos naturais, relacionados na tabela a seguir:
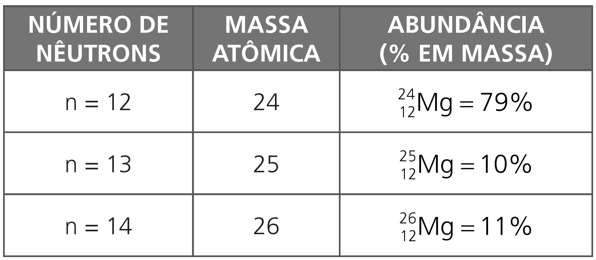
A massa atômica oficial do elemento químico magnésio será:

- Apenas os isótopos do elemento químico hidrogênio possuem nomes próprios, os demais são diferenciados apenas pelo número de massa.





