Elementos como a prata, o ouro, o cobre e o chumbo já eram conhecidos desde os tempos antigos, mas a primeira descoberta científica de um elemento só aconteceu em 1669, quando o alquimista Henning Brand descobriu o fósforo. Nos próximos 200 anos após essa descoberta, dezenas de outros elementos foram encontrados na natureza. Com isso, surgiu a necessidade de organizá-los, e então os cientistas iniciaram a busca por propriedades que servissem como critério de classificação.
(Texto retirado de www.tabelaperiodicacompleta.com)
DALTON E AS MASSAS ATÔMICAS
A primeira tentativa de organização foi feita no início do século XIX, pelo químico e físico inglês John Dalton. Nessa época, os valores aproximados das massas atômicas de alguns elementos já haviam sido estabelecidos.
Dalton listou os elementos conhecidos em ordem crescente de massas atômicas, descrevendo as propriedades de cada um e os compostos formados por eles. Entretanto, essa classificação não fazia sentido, já que deixava bastante afastados entre si elementos com propriedades muito semelhantes. Os próprios valores das massas atômicas eram duvidosos, pois foi Dalton mesmo quem os calculou baseado em dados imprecisos. O cientista tomou o hidrogênio, que experimentalmente já havia sido verificado como o elemento mais leve conhecido, e atribuiu a ele um “peso nocional relativo” igual a 1. As massas dos demais elementos foram estabelecidas em relação ao hidrogênio, e esse método resultou em muitos erros.

AS TRÍADES DE DÖBEREINER
Em 1829, foi a vez do químico alemão Johann Wolfgang Döbereiner dar sua contribuição à ciência. Döbereiner analisou os elementos cálcio, estrôncio e bário, e percebeu que a massa do átomo de estrôncio correspondia, aproximadamente, à média dos valores das massas atômicas do cálcio e do bário. O químico observou que essa relação também se dava em outra tríade, como enxofre-selênio-telúrio e cloro-bromo-iodo.
Döbereiner foi o primeiro cientista a relacionar os elementos químicos conhecidos com base em um determinado critério, entretanto, suas observações não foram tidas como relevantes pela comunidade científica da época. Uma das falhas do seu método é que muitos metais não podiam ser agrupados em tríades.
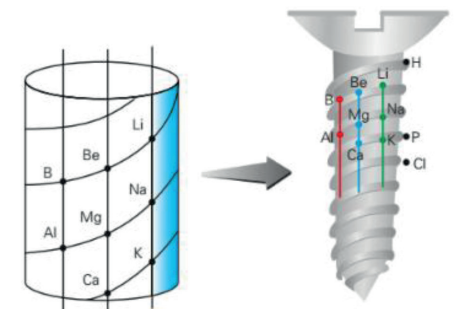
O PARAFUSO TELÚRICO DE CHANCOURTOIS
Mais tarde, em 1862, o geólogo francês Alexandre Chancourtois propôs o modelo que ficou conhecido como parafuso telúrico. Em uma espiral desenhada na face externa de um cilindro, ele organizou os elementos químicos em ordem crescente de massas atômicas. O cilindro era dividido por linhas verticais em 16 faixas, de modo que os elementos que possuíam propriedades semelhantes apareciam uns sobre os outros dentro dessas faixas. Esse modelo relacionava as propriedades dos elementos químicos às posições que eles ocupavam na sequência. O problema era: havia elementos que, apesar de estarem em posição correta na ordem crescente, apresentavam propriedades diferentes dos demais elementos situados na mesma faixa, o que invalidava o padrão. Por isso, o parafuso telúrico despertou pouco interesse.
A LEI DAS OITAVAS DE NEWLANDS
Outra ideia foi a do químico inglês John Alexander Newlands, que se inspirou na música. Sabe-se que, em uma sequência crescente de sete notas iniciada em dó, a oitava nota é dó novamente e depois dela a sequência se repete. Em 1864, Newlands elaborou uma periodicidade semelhante a essa para ser aplicada aos elementos químicos. Ele enfileirou os elementos conhecidos na época em linhas horizontais, sete em cada linha, em ordem crescente de massas atômicas. As linhas eram posicionadas umas sobre as outras. O primeiro elemento de cada era o oitavo em relação à linha anterior e tinha as mesmas propriedades do primeiro elemento dessa linha anterior. O mesmo acontecia com o segundo elemento, o terceiro, e assim sucessivamente. Nessa forma de classificação, a cada oito elementos as propriedades se repetiam, por isso a proposta de Newlands recebeu o nome de “Lei das Oitavas”.
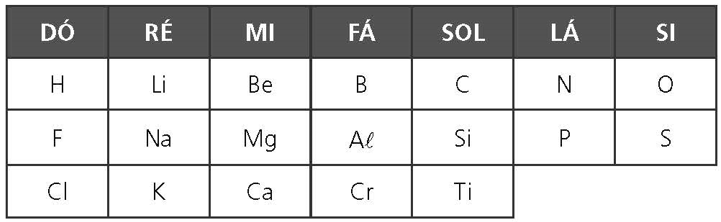
Entretanto, o modelo só se mostrava coerente até chegar ao cálcio e não valia para os elementos que vinham depois dele, conforme a ordem crescente de massas atômicas. A tentativa de associar a química à música rendeu a Newlands o desprezo da Sociedade Química de Londres. Apesar disso, hoje ele é reconhecido como o cientista que trouxe a noção de periodicidade para o campo da química, e seu trabalho é tido como precursor do de Mendeleiev.
A TABELA PERIÓDICA DOS ELEMENTOS DE MENDELEIEV
Dimitri Ivanovich Mendeleiev foi um químico russo que ficou conhecido como o pai da Tabela Periódica. Sua dedicação à sistematização dos elementos químicos começou em 1860, quando ele iniciou um trabalho de agrupamento dos elementos de acordo com suas propriedades comuns. A essa altura, já se sabia que os elementos tinham massas atômicas diferentes e era comum organizá-los em ordem crescente de massas atômicas. Mas, Mendeleiev acreditava que isso não era tudo. Certa ocasião, após ter passado alguns dias revisando exaustivamente todo o seu conhecimento químico e as tentativas de sistematização já feitas por outros cientistas, ele começou a escrever os elementos agrupando-os conforme as propriedades químicas que eles apresentavam. O problema era que essa classificação juntava elementos de massas atômicas muito distantes entre si.
Ao mesmo tempo em que se sentia desanimado por saber que o padrão de organização observado em sua tentativa não se aplicava a todos os elementos conhecidos na época, Mendeleiev intuía que tal padrão não emergia por acaso. Afinal de contas, Chancourtois (que propôs o “parafuso telúrico”) também havia percebido um padrão e esbarrado no mesmo problema: o fato de ele não se aplicar a todos os elementos. Mendeleiev confiava no conhecimento químico de Chancourtois e não acreditava que ele pudesse estar errado, por isso continuou seguindo as mesmas pistas, mas sem sucesso.
As coisas começaram a ficar mais claras para Mendeleiev quando ele teve a ideia de associar a classificação dos elementos ao seu jogo de cartas preferido: o jogo de paciência. Foi então que ele tomou uma série de fichas de papel e começou a escrever em cada uma delas o nome de um elemento, acompanhado de sua massa atômica e propriedades químicas. Terminado o “baralho” de elementos químicos, Mendeleiev começou a ordenar os cartões como se faz no jogo de paciência: os elementos de propriedades químicas semelhantes eram como cartas pertencentes ao mesmo naipe, e dentro de cada um desses “naipes” a ordem crescente de massas atômicas era como a ordem numérica crescente das cartas. A ironia é que ele chamou esse jogo de “paciência química” sem saber que precisaria realmente de muita paciência em sua jornada. Depois de organizados os cartões, o químico percebeu que sua intuição estava conduzindo-o na direção certa, mas ainda assim a “paciência química” era imperfeita. Foi então que, vencido pelo cansaço, adormeceu sobre a mesa de estudo e teve um sonho. “Vi num sonho uma tabela em que todos os elementos se encaixavam como requerido. Ao despertar, escrevi-a imediatamente numa folha de papel”, contou Mendeleiev depois.
O sonho mostrou ao cientista como se encaixavam os conhecimentos que ele já possuía, mas não conseguia articular conscientemente. Ao acordar e transpor para o papel o que havia sonhado, Mendeleiev percebeu a lógica por trás do esquema: quando os elementos são listados em ordem crescente de massas atômicas, as propriedades químicas apresentadas por eles se repetem periodicamente. Por essa razão, chamou o modelo de “Tabela Periódica dos Elementos”.
Duas semanas depois de ter feito a descoberta, Mendeleiev apresentou-a à comunidade científica, publicando o artigo intitulado “Um sistema sugerido dos elementos”. O ano era 1869. A princípio, a Tabela listava os elementos verticalmente em ordem crescente de massas atômicas, e na horizontal os agrupava segundo suas propriedades químicas.


A Tabela Periódica, de certa forma, incorporava os modelos anteriores propostos por Döbereiner, Chancourtois e Newlands, mesmo que a validade desses padrões só fosse verificada em determinados trechos da Tabela. Além disso, nela se encaixavam todos os elementos conhecidos na época. Mas Mendeleiev ainda percebia incoerências em seu modelo. Uma delas eram os elementos que, embora estivessem no mesmo grupo que outros elementos de propriedades semelhantes, tinham massa atômica que não se encaixava na ordem crescente. Nesses casos, Mendeleiev desafiou a ciência ao defender que o problema não estava em seu sistema de classificação, e sim no cálculo da massa atômica do elemento, que estava errada.
Outra aparente falha da Tabela Periódica era a inexistência de elementos que apresentassem determinados valores de massas atômicas necessários à continuidade da sequência crescente. Para esse problema, o cientista adotou uma solução simples, mas ousada: deixava lacunas correspondentes a eles e continuava a sequência com os elementos conhecidos. Ele tinha certeza de que os elementos correspondentes às lacunas existiam, apenas não tinham sido descobertos ainda. Sua segurança era tanta que o químico arriscou até mesmo prever as propriedades de alguns daqueles elementos desconhecidos, baseando seus palpites na massa atômica que eles deveriam ter e na posição que a lacuna ocupava na Tabela.
MOSELEY E OS NÚMEROS ATÔMICOS
No início do século XX, por volta de 1913, o físico inglês Henry Gwyn-Jeffreys Moseley examinou os espectros dos raios-X característicos de cerca de 40 elementos. Neste estudo, descobriu que todos os átomos de um mesmo elemento químico tinham carga nuclear idêntica, o que indicava que possuíam o mesmo número de prótons em seus núcleos. O número de prótons que um elemento possui em seu núcleo corresponde ao seu número atômico. O físico observou que quando os elementos eram colocados em ordem crescente de números atômicos, suas propriedades se repetiam periodicamente.
Não levou muito tempo para que Moseley chegasse à conclusão de que o número atômico podia ser usado como critério de organização dos elementos químicos, em vez da massa atômica. A aplicação desse padrão corrigiu as falhas existentes nas tabelas de Mendeleiev e de Meyer. As poucas lacunas que ainda persistiram na Tabela foram preenchidas mais tarde por alguns elementos descobertos e outros sintetizados em laboratório. Assim, chegou-se a uma versão da Tabela Periódica muito parecida com a que temos atualmente, composta por linhas chamadas “períodos (ou níveis)” e colunas chamadas ”famílias (ou grupos)”.

SEABORG E OS ELEMENTOS TRANSURÂNICOS
A última grande alteração aplicada à Tabela Periódica foi resultado do trabalho de Glenn Theodore Seaborg. Dentro do Projeto Manhattan, que trabalhava para desenvolver a bomba atômica, Seaborg foi chefe da divisão que lidava com os elementos transurânicos (ou seja, os elementos com número atômico superior a 92, que é o número atômico do urânio). Ao lado de E. M. McMillan, J. W. Kennedy e A. C. Wahl, o cientista americano descobriu o plutônio. Depois descobriu outros quatro elementos transurânicos e participou da descoberta de mais cinco.
Em 1944, Seaborg levantou a hipótese de que os elementos com número atômico superior ao do actínio (que é igual a 98) formavam uma série de elementos semelhantes à série dos lantanídeos. A partir dessa hipótese, foi possível explicar propriedades químicas de alguns elementos já conhecidos e até a de outros que ainda não haviam sido identificados. Em 1945, o cientista publicou uma versão da Tabela Periódica que incluía os elementos transurânicos recentemente descobertos. A configuração dessa Tabela diferia da anterior por trazer a série dos actinídeos abaixo da série dos lantanídeos. Em 1951, Seaborg recebeu o Prêmio Nobel de Química. O elemento 106 da Tabela Periódica chama-se Seabórgio em homenagem a ele.





