Transformações gasosas
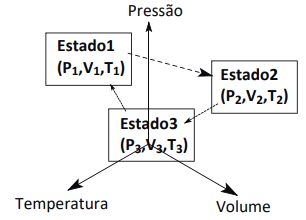
As leis de transformações gasosas foram desenvolvidas no século XVII através de observações experimentais e suas equações matemáticas foram obtidas de forma empírica.
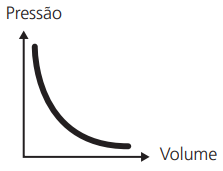
TRANSFORMAÇÕES ISOTÉRMICAS (LEI DE BOYLE – MARIOTTE)
Numa transformação em temperatura constante, o volume V, ocupado por uma massa gasosa, é inversamente proporcional à pressão a que está submetida.

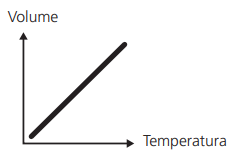
TRANSFORMAÇÕES ISOBÁRICAS (LEI DE CHARLES)
À pressão constante, o volume ocupado por determinada massa gasosa é diretamente proporcional à sua temperatura absoluta.

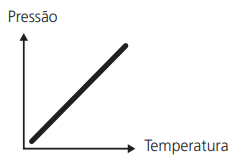
TRANSFORMAÇÕES ISOVOLUMÉTRICAS, ISOMÉTRICAS OU ISOCÓRICAS (LEI DE GAY-LUSSAC)
A um volume constante, a pressão exercida por uma determinada massa gasosa é diretamente proporcional à sua temperatura absoluta.

Exemplos:
01. O gráfico ilustra a isoterma de certa quantidade de gás que é levado do estado A para o estado C.
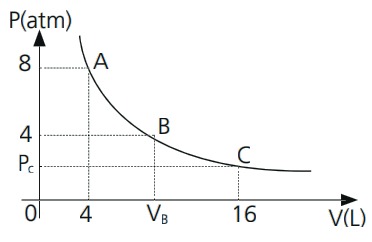
Determine:
a) o volume do gás no estado B;
b) a pressão do gás no estado C.
Resolução:
a) A transformação A → B é isotérmica, dessa forma é correto escrever: PAVA = PBVB → (8)(4) =(4)VB → VB = 8 L
b) A transformação A → C é isotérmica, dessa forma é correto escrever: PAVA = PCVC → (8)(4) = PC(16) → PC = 2 atm
VOLUME MOLAR (VM)
É o volume ocupado por um mol de um gás ideal.
Condições normais de temperatura e pressão (CNTP)

Condições ambientes de temperatura e pressão (CATP)
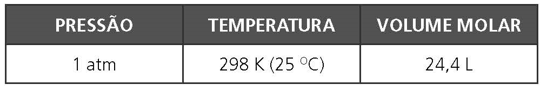
Condições padrões de temperatura e pressão (STP)

Exemplos:
01. Qual é a massa de gás butano (C4H10) que, nas CNTP, ocupa um volume de 672 Litros?
Resolução:
Massa Molar do Butano (C4H10) = 4(12) + 10(1) = 58 g/mol.

02. Qual o volume, nas C.A.T.P. ocupado por é 1,8 · 1025 moléculas de gás metano (CH4)?
Resolução:

03. Uma amostra de gás acetileno (C2H2) se encontra nas CNTP. Determine o seu volume, sabendo que essa amostra apresenta um total de 9,6 · 1026 átomos.
Resolução:
Massa Molar do Acetileno (C2H2) = 2(12) + 2(1) = 26 g/mol.





