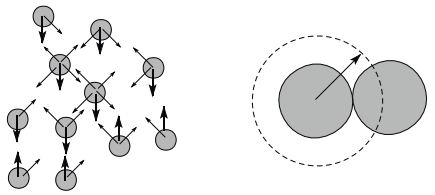
São características de um gás real:
a. Suas forças moleculares não são desprezíveis
b. O volume do gás apresenta é menor do que a medida do recipiente que o contém.
No caso de um gás real, por não atender as condições acima, podemos substituir a equação de Clapeyron pela equação de Van der Waals:

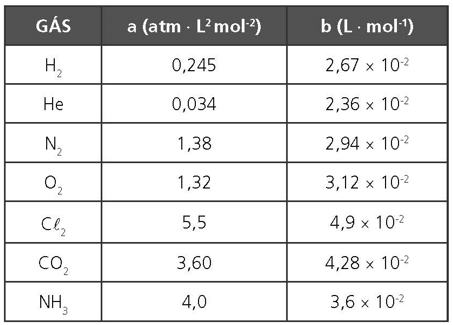
Os valores de a e b dependem da natureza do gás. A constante a, é denominada de coesão, ela procura avaliar a intensidade das forças intermoleculares. Já a constante b, é denominada de co-volume, está associada ao espaço real ocupado pelas moléculas do gás.
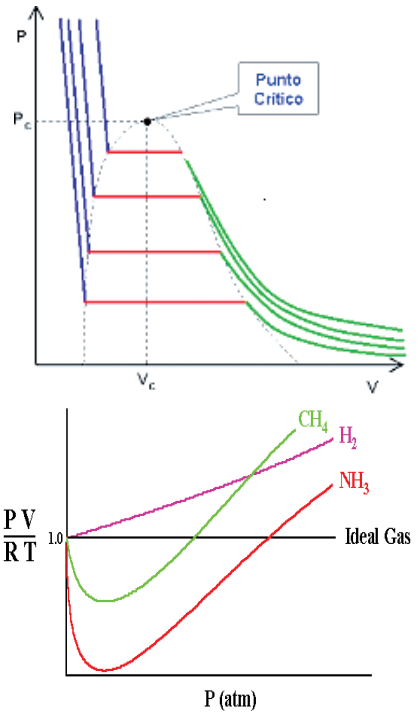

Um gás real poderá ter um comportamento próximo de um gás ideal em pressões muito baixas e de temperaturas muito altas.
Exemplo:
Compare a pressão exercida por 1,0 mol de etano, apresentando uma volume de 22,4 L à 273 K se comportando como um gás ideal e como um gás de Van der Waals.
Isoterma de um Gás Real
Dado
a = 6 atm ⋅ L2 ⋅ mol−2
b = 7 · 10−2 L ⋅ mol−1
R = 0,082 atm ⋅ L ⋅ mol−1 ⋅ K−1
Resolução:
O gás se comportando como gás ideal:
P(22,4) = (1)(0,082)(273) → P = 0,999 atm
O gás se comportando como de Van der Waals:





