MASSA MOLAR E O MOL
Para o estudo da massa do átomo e das massas das moléculas adotou-se um padrão de medida a partir da massa do Carbono-12.
O ¹²C possui 6 prótons, 6 nêutrons e 6 elétrons em sua última camada. A massa do próton é aproximadamente igual a massa do nêutron enquanto a massa do elétron é muito pequena com as massas anteriores.

Experimentalmente temos
1u ≅ 1,66057 · 10-27
massa do próton = massa do nêutron = 1u
O MOL
O mol é utilizado para contagem de partículas como átomos e moléculas.
1 mol = 6,023 · 1023 partículas
O número 6,023 · 1023 é conhecido como número de Avogrado (NA).
N = 6,023 ⋅ 1023 partículas/mol = 6,023 ⋅ 1023 mol-1
MASSA MOLAR
Para qualquer elemento a massa molar é a massa de 1 mol de átomos desse elemento. A massa molar de um elemento é dada substituindo-se a unidade u da massa atômica pela unidade grama por mol.
Por exemplo a massa molar do enxofre (S), cuja massa atômica é aproximadamente 32 u, será
M = 32 g/mol
Teremos a seguinte relação entre o número de mols de um elemento (n), a massa molar (M) e a massa (m) desse elemento.

GÁS IDEAL
Alguns autores fazem distinções entre gás ideal e gás perfeito, mas alguns não. Vamos, assim como estes, tratar como sinônimos. Começaremos com as características de um gás perfeito ou ideal:
- É composto de partículas puntiformes (sem dimensão).
- Não há força elétrica entre as partículas (distância grande entre elas).
- As moléculas movem-se desordenadamente, havendo a cada instante um grande número de moléculas movendo-se em todas as direções;
- As moléculas não exercem ação mútua, a não ser durante as eventuais colisões;
- As moléculas chocam-se elasticamente umas com as outras e com as paredes do recipiente.
LEI DE BOYLE
As três variáveis de um gás são pressão, temperatura e volume e são sempre estudadas mantendo-se uma delas constante.
O físico inglês Robert Boyle e o físico francês Edme Mariotte realizaram experimentos de variação da pressão e do volume dos gases com a temperatura constante. Este tipo de transformação que deixa a temperatura constante é chamada de isoterma.
Através de experiências com todos os gases Boyle e Mariotte observaram uma relação entre a pressão e o volume desses gases que ficou conhecido como Lei de Boyle.
Em um sistema fechado em que a temperatura é mantida constante, verifica-se que determinada massa de gás ocupa um volume inversamente proporcional a sua pressão.
P · V = constante
Dessa forma temos a transformação isotérmica.
Pressão e volume são inversamente proporcionais. A temperatura permanece inalterada.
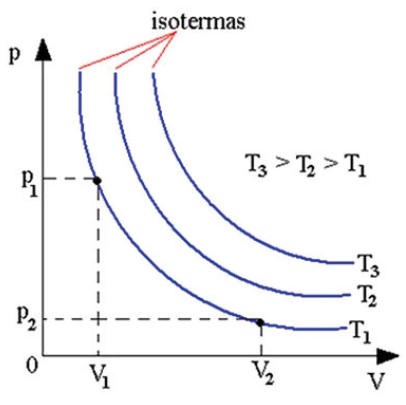
P1V1 = P2V2
A isoterma é uma hipérbole. Quanto maior o produto P · V, maior T, ou seja, quanto mais afastada a hipérbole está da origem, maior será a temperatura do gás durante o processo. Neste casso, T3 > T2 >T1.
LEIS DE CHALES/GAY-LUSSAC
Depois da análise entre volume e pressão mantendo-se a temperatura constante para um gás o físico francês Jacques Alexandre César Charles começou a analisar as relações entre pressão e temperatura (mantido constante o volume) e entre volume e temperatura (mantida constante a pressão) e algum tempo depois o francês, Louis Joseph gay-Lussac, realizou uma série de experimentos que estabeleceram as relações procuradas.
TRANSFORMAÇÃO ISOBÁRICA
É quando um gás sofre alteração no seu volume e temperatura, mas sem alterar a sua pressão.
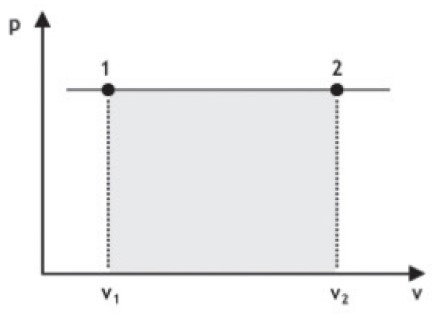
Pela equação dos gases perfeitos, podemos perceber que, se o gás vai de 1 para 2, seu volume aumenta, e como a pressão é constante, significa que a temperatura do gás aumenta. Se for de 2 para 1, a temperatura diminui.

Observação: Para realizar essa relação ou qualquer outra que seja originada da equação dos gases perfeitos, a temperatura deve estar sempre em Kelvin. Basta ver as unidades da constante R.
TRANSFORMAÇÃO ISOCÓRICA
Nesse caso a pressão e a temperatura são diretamente proporcionais. O volume é constante.
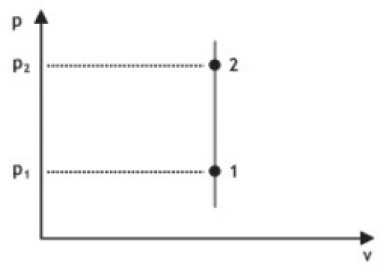
Analogamente:

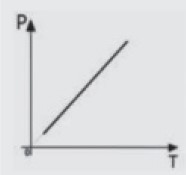
Observação: Os gráficos podem ser P × T, V × T e etc. A representação P × V é a mais comum. Neste último caso, por exemplo, poderíamos ter escolhido P × T para representar a transformação: A reta nunca tocará o zero Kelvin, o domínio desta função é (0, +∞).
Exemplo: Certo gás está confinado em um recipiente hermeticamente fechado e inextensível. A temperatura do recipiente aumenta, aumentando a temperatura do gás em seu interior de 27 ºC para 227 ºC. Qual a relação entre a pressão final e inicial que o gás está submetido?
Resolução: Como o recipiente está hermeticamente fechado, o número de mols (n) é constante.
Inextensível, ou seja, volume constante. Então:

LEI GERAL DOS GASES IDEAIS
Depois de estabelecidas as Leis de Gay-Lussac, percebeu-se que elas poderiam, juntamente com a Lei de Boyle, ser reunidas numa única lei:

Transformação isotérmica (T1 = T2)

Transformação isobárica (P1 = P2)

Transformação isocórica (V1 = V2)

EQUAÇÃO DE CLAPEYRON
Émile Clapeyron (1799-1864) concluiu, experimentalmente, que a constante acima é proporcional ao número de moléculas do gás, isto é,

em que n é o número de mols de moléculas do gás. A constante R tem o mesmo valor para todos os gases; por esse motivo é chamada constante universal dos gases ideais.
Assim podemos escrever
P · V = n · R · T
A equação acima é conhecida como equação de Clapeyron.
UNIDADES DE R

É comum utilizarmos

No Sl a unidade de pressão é o Pascal (Pa) e a unidade de volume é o metro cúbico (m³). Lembrando que 1 atm = 1,01325 ⋅ 105 Pa e 1 L = 10-3 m3, a igualdade anterior fica:

Ou como veremos Pa · m³ = J e assim

Exemplo: Ao abrir uma garrafa de um refrigerante, nota-se que certa quantidade de gás escapará. Vamos supor que, durante certo intervalo de tempo, 10 % do gás escapou. Qual a relação entre as pressões inicial e final sofrida pelo gás? Vamos considerá-lo ideal.
Resolução: Antes de a garrafa ser aberta:
P1 · V = n · R · T
Depois de o gás vazar:
P2 · V = 0,9n · RT
Dividindo a 1ª pela 2ª:

Algo que naturalmente já sabíamos, após abrirmos um refrigerante, a pressão no interior da latinha reduz, se igualando à pressão externa.
ESTADO NORMAL E VOLUME MOLAR DE UM GÁS
Quando um gás está sob pressão de 1 atm e temperatura de 273 K (ou 0 ºC), dizemos que ele está nas condições normais de temperatura e pressão (CNTP), ou então, simplesmente, que está no estado normal. O volume de um mol de moléculas de um gás é chamado de volume molar do gás.
Sendo assim

Assim, pela Equação de Clapeyron:

DENSIDADE DE UM GÁS IDEAL

Da equação de Clapeyron temos PV = n . R . T





