São características de um gás ideal ou perfeito:
- Suas forças moleculares são desprezíveis;
- O volume do gás apresenta a mesma medida do recipiente que o contém;
- Um gás real se aproxima da idealidade quando se encontra em elevada temperatura e baixíssima pressão.

EQUAÇÃO DE CLAPEYRON
Descreve um determinado estado de um gás ideal.
P ⋅ V = n ⋅ R ⋅ T
CONSTANTE UNIVERSAL DOS GASES (R)
Seu valor depende das unidades usadas para medir pressão e volume.
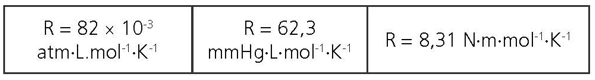
Exemplos:
01. No gráfico a seguir estão representados duas isotermas (lei de Boyle-Mariotte) de uma massa x de gás ideal, de massa molar igual 28 g·mol-1, uma à temperatura de 27 ºC e a outra à temperatura T2 . Dada a Constante Universal dos Gases (R) = 0,08 atm · L · mol-1· K-1.
a) Qual o valor da pressão p1, indicada no gráfico, em atm?
b) Determine o valor da temperatura T2 em ºC.
c) Determine, em gramas, a massa x do gás.
Resolução:
a) De A para C, temos uma transformação isotérmica, logo podemos estabelecer a seguinte relação: PAVA = PCVC → (P1)(2) = (1)(10) → P1 = 5 atm.
b) De A para B, temos uma transformação isobárica, logo podemos estabelecer a seguinte relação:

c) Aplicando a Equação de Clapeyron no ponto A, temos:


02. Um recipiente de 400 L contém uma amostra de gás etano (C2H6), na pressão de 2 atm e temperatura de 27 ºC. Determine, em quilogramas, a massa de etano contida no recipiente.
Dado: R = 0,08 atm · L · mol-1 ⋅ K−1.
Resolução:
Massa Molar do Etano (C2H6) = 2(12) + 6(1) = 30 g/mol. Aplicando a Equação de Clapeyron, temos:





