SAIS
São compostos, em geral, produzidos a partir de uma reação de salificação, ou ainda: sais são substâncias que, em solução aquosa, se dissociam ionicamente liberando, na forma de ânions, diferentes íons OH– e qualquer cátion diferente de H+ (H3O+).

Apesar de muitos sais serem altamente tóxicos, vários deles são utilizados em nosso cotidiano. Podemos citar como exemplos:
- o cloreto de sódio (NaCℓ), também conhecido como sal de cozinha, é utilizado em nossa alimentação diária;
- o bicarbonato de sódio (NaHCO3), usado como antiácido e no preparo de bolos e bolachas;
- o sulfato de sódio (Na2SO4) e o sulfato de magnésio (MgSO4), usados como purgante;
- o sulfato de cálcio di-hidratado (CaSO4 · 2H2O), também conhecido como gesso, é utilizado em ortopedia e em construções.

Entre um ácido e uma base ocorre uma reação chamada de neutralização ou salificação. Pode-se dizer que quando se mistura um ácido e uma base, ocorre a formação do sal e de água. Assim temos:
ácido + base → sal + H2O
Exemplo:
HCℓ + NaOH → NaCℓ + H2O
CLASSIFICAÇÃO DE SAIS
Os sais podem ser classificados de acordo com vários critérios
PRESENÇA DE OXIGÊNIO NA MOLÉCULA
A molécula de um sal pode apresentar ou não o elemento oxigênio. Assim, conforme a presença ou não desse elemento, temos:
SAL HALOIDES OU NÃO OXIGENADO
Sal cuja molécula não contém oxigênio.
Exemplos:
NaCℓ, K2S, Ca(CN)2
OXISSAIS OU OXIGENADOS
Exemplos:
NaNO3, K2SO4, Aℓ3PO4
NÚMERO DE ELEMENTOS NA MOLÉCULA
A molécula de um sal pode apresentar dois ou mais elementos. Assim, conforme a quantidade de elementos, temos:
SAL BINÁRIO
Sal cuja molécula contém dois elementos.
Exemplo:
KCℓ, Na2S, CaS
SAL TERNÁRIO
Sal cuja molécula contém três elementos.
Exemplo:
NaNO3, K2SO4, Aℓ3PO4
SAL QUARTENÁRIO
Sal cuja molécula contém quatro elementos.
Exemplo:
NH2CℓO3, K3Fe(CN)6, NaOCN
NATUREZA DOS ÍONS
SAL NORMAL
Sal que não apresenta hidrogênio ionizável e nem íons OH–. É formado pela neutralização total do ácido e total da base, logo, podemos dizer que sal normal é o produto de uma neutralização total entre um ácido e uma base. Todo sal é constituído pelo cátion de uma base e pelo ânion de um ácido, sendo, por isso mesmo, um composto iônico.
Exemplo:
NaCℓ, KNO3, CaCO3, K2SO4
Para escrevermos a fórmula de um sal normal, obedecemos ao seguinte esquema:
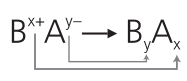
Nesse esquema:
Bxt é o cátion proveniente da base;
Ay− é o ânion proveniente do ácido.
Veja os exemplos:
a) brometo de potássio
cátion potássio: K1+
ânion brometo: Br1−
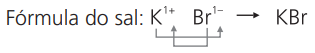
b) sulfito de sódio
cátion sódio: Na1+
ânion sulfito: SO2-3
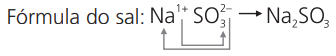
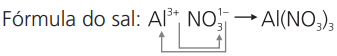
c) nitrato de alumínio
cátion alumínio: Aℓ3+
ânion nitrato: NO1-3
HIDROGENOSSAL
Sal que apresenta hidrogênio ionizável. É formado pela neutralização parcial do ácido e total da base.
Exemplos:
NaHCO3, NaH2PO4, KHSO4, NaHS
HIDROXISSAL
Sal que apresenta OH-. É formado pela neutralização parcial da base e total do ácido.
Exemplos:
Ca(OH)Br, Bi(OH)2Cℓ
SAL DUPLO
Sal que apresenta dois cátions diferentes que não sejam hidrogênio ionizável ou dois ânions diferentes que não sejam íons OH-.
Exemplos:
NaKCO3, AℓCℓF2, CaBrCℓ, CaKPO4
SAL HIDRATADO
Sal que apresenta moléculas de água em seu retículo cristalino. Esta água é chamada de água de cristalização ou de hidratação, sendo a sua quantidade indicada, na nomenclatura do sal, por prefixos.
Exemplos:

NOMENCLATURA DE SAIS
A nomenclatura dos sais é similar à do ácido e da base que lhe deram origem. O ácido sempre formará o ânion correspondente do sal, portanto, o nome do ânion será derivado do ácido:
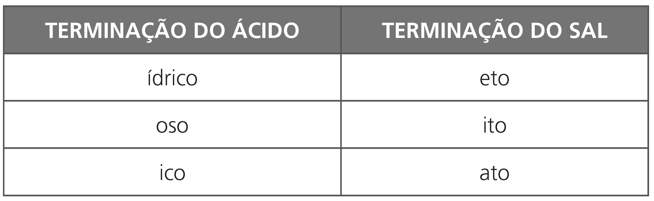
Exemplo geral:
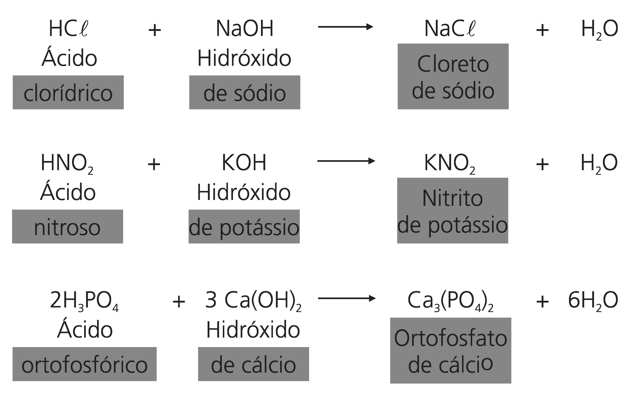
Exemplos:

A base sempre formará o cátion correspondente do sal. Portanto, o nome do cátion será derivado da base. Então:
nome do ânion de nome do cátion
Exemplos:
NaCℓ – cloreto de sódio
CaCO3 – carbonato de cálcio
MgSO4 – sulfato de magnésio
NH4NO3 – nitrato de amônio
PARA ELEMENTOS COM 2 NOX POSSÍVEIS
PELO NOX ABSOLUTO DO ELEMENTO FORMADO DO SAL
nome do ânion de nome do cátion Nox
Observação: NOX expresso em algarismo romano.
Exemplos:
FeCℓ3 – cloreto de ferro III
FeCℓ2 – cloreto de ferro II
Cu2SO4 – sulfato de cobre I
CuSO4 – sulfato de cobre II
PELO NOX RELATIVO

Exemplos:
FeCℓ3 – cloreto férrico
FeCℓ2 – cloreto ferroso
Cu2SO4 – sulfato cuproso
CuSO4 – sulfato cúprico
PARA HIDROGENOSSAIS

Observação: Hidrogenossais provenientes de diácidos podem apresentar o prefixo -bi na nomenclatura do sal.
Exemplos:
NaHCO3 – monohidrogenocarbonato de sódio ou bicarbonato de sódio.
KHSO4 – monohidrogenosulfato de potássio ou bissulfato de potássio.
(NH4)H2PO4 – di-hidrogenofosfato de amônio
PARA HIDROXISSAIS
Bi(OH)2Cℓ – di-hidroxicloreto de bismuto
Aℓ(OH)2NO3 – di-hidroxinitrato de alumínio
PARA SAIS DUPLOS
SAIS DUPLOS COM DOIS ÂNIONS
nome dos dois ânions de nome do cátion
Exemplos:
AℓCℓF2 – fluoreto – cloreto de alumínio
CaBrCℓ – cloreto – brometo de cálcio
SAIS DUPLOS COM DOIS CÁTIONS
nome dos ânions de nome dos dois cátions
Exemplos:
NaKCO3 – carbonato de sódio e potássio
CaKPO4 – fosfato de cálcio e potássio
FORMULAÇÕES DE SAIS
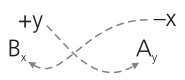
Exemplos:
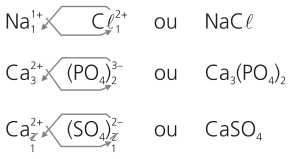
Observação:
NEUTRALIZAÇÃO TOTAL X NEUTRALIZAÇÃO PARCIAL
As neutralizações totais são reações entre ácidos e bases de Arrhenius, em que não há sobra de H+ ou de OH-, por exemplo:

Já as neutralizações parciais são reações químicas entre ácidos e bases de Arrhenius, em que há sobra de H+ ou de OH–, que ficará incorporada à estrutura do sal, tornando-o um sal ácido ou básico, em geral.

OS SAIS DUPLOS OU MISTOS
São sais provenientes da reação de neutralização entre dois ácidos e uma base ou um ácido e duas bases. Com isso, um sal duplo ou misto tem, pelo menos, dois cátions ou dois ânions.

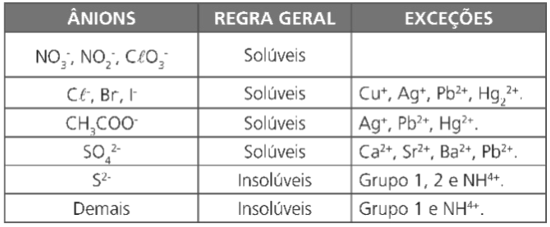
PRINCIPAIS REGRAS DE SOLUBILIDADE DE SAIS
- Todos os sais com cátions da família 1A (grupo I) e NH+4 são solúveis.
- Todos os sais em que o ânion for nitrato (NO3-), nitrito (NO2-) ou clorato (CℓO3-) são solúveis.
- Praticamente todos os sais de cloretos (Cℓ–), brometos (Br–) e iodetos (I)– são solúveis, exceto quando o cátion for Ag+, Pb2+ e Hg2+. Sais como AgCℓ (precipitado branco) e PbI2 (precipitado amarelo) são praticamente insolúveis.
- Praticamente todos os sais de sulfatos (SO4)2- são solúveis, exceto quando o cátion for Ca2+, Ba2+, Sr2+ e Pb2+.
- Praticamente todos os sais de sulfetos (S)2- são quase totalmente insolúveis, menos para os cátions das famílias 1A, 2A e o NH+4, que tornam o íon sulfeto solúvel.
- Praticamente todos os sais formados pelos demais ânions são quase totalmente insolúveis, excetuando evidentemente aqueles em que os cátions são da família 1A ou o NH+4
De uma forma geral, podemos dizer que:
PRINCIPAIS SAIS NO NOSSO COTIDIANO (QUI_1011 – PROENEM)
- Cloreto de sódio (NaCℓ) é conhecido como sal marinho ou sal gema. Constitui o sal de cozinha. Está presente no soro fisiológico com uma concentração de 0,9%.
- Nitrato de sódio (NaNO3) é usado em fertilizantes, propelentes de foguetes e na fabricação de vidro. É usado na preservação de alimentos embutidos, como linguiças e salames.
- Carbonato de cálcio (CaCO3) está presente no mármore, calcário e na casca do ovo. É usado na produção da cal virgem ou cal viva, do cimento e do creme dental. É muito utilizado na agricultura para a correção da acidez do solo.
- Hipoclorito de sódio (NaCℓO) é chamado de água sanitária. Usado na purificação e no tratamento de água e como alvejante.
- Hidrogenocarbonato de sódio (NaHCO3), conhecido também como bicarbonato de sódio. É princípio ativo de efervescentes no combate à acidez estomacal. Usado como fermento em massas e um dos componentes de extintores de incêndio.
Curiosidades:
O bicarbonato de sódio é um ingrediente que possui diversas utilidades. As suas funções podem variar, desde a utilização na culinária até a limpeza.
A polivalência do bicarbonato pode ser explicada pela sua fórmula química – NaHCO3 . É um composto químico classificado como um sal e apresenta uma leve alcalinidade e assim, ajuda a controlar o pH e mantê-lo em torno de 7.
Esse composto pode ser utilizado para esfoliação caseira, ajuda a manter o pH do couro cabeludo, diminuindo os riscos de proliferação de fungos e bactérias, é muito utilizado por dentistas para a retirada de placa bacteriana e é o principal componente do fermento para massas.

Fonte: https://image.shutterstock.com




