Apesar das substâncias químicas possuírem propriedades específicas como ponto de fusão, ponto de ebulição e densidade que designam inequivocamente de qual substância se trata, existem também propriedades mais gerais, que podem ser semelhantes a um grupo de substâncias. Por exemplo: suco de limão, suco de laranja, vinagre e outros com sabor azedo. Já bananas verdes tendem a amargar a língua. O conjunto de substâncias químicas com propriedades químicas semelhantes chamamos de função química.
FUNÇÃO ÓXIDO
Óxidos são compostos moleculares ou iônicos binários, ou seja, formados por dois elementos, sendo o oxigênio o elemento mais eletronegativo.
Exemplos:

a) Os compostos OF2 e O2F2 não são óxidos, uma vez que o flúor é o único elemento mais eletronegativo que o oxigênio.
OF2 → fluoreto de oxigênio → não é óxido
O2F2 → difluoreto de oxigênio → não é óxido.
b) Entende-se por compostos binários aqueles que possuem dois elementos. Por ternários, três elementos e por quaternários, quatro elementos.
Portanto, além do oxigênio em um óxido, existe um outro elemento químico que chamaremos genericamente de A que, por sua vez, terá carga +x. Certamente que a carga de A é positiva, já que em um óxido, o oxigênio sempre terá carga negativa. Este elemento A pode ser um metal ou um ametal. No caso de A ser metal, a ligação entre A e o oxigênio é iônica, e o óxido será iônico e certamente sólido. Se A for ametal, a ligação entre A e o oxigênio é covalente, e, portanto, o óxido será molecular, podendo ser sólido, líquido ou gasoso.
Por exemplo:
- o composto SO2 é binário e o elemento mais eletronegativo é o oxigênio (portanto, o composto também é um óxido). Como o elemento genérico A é o enxofre (um ametal), este é um óxido molecular;
- o composto FeO é binário e o elemento mais eletronegativo é o oxigênio (portanto, o composto também é um óxido). Como o elemento genérico A é o ferro (um metal), este é um óxido iônico.
CLASSIFICAÇÃO DE ÓXIDOS
Ainda sobre óxidos, devemos salientar que são compostos de propriedades muito variadas, pois existem os moleculares e também os iônicos. Alguns são excelentes eletrólitos, outros nem tanto. Alguns são sólidos, outros são líquidos e outros são gasosos. Uns são extremamente estáveis, outros chegam a explodir devido às suas instabilidades. Como não há propriedades gerais para os óxidos, costuma-se dividi-los em 7 grupos menores, cada grupo com características mais peculiares.
São eles:
- óxidos ácidos;
- óxidos básicos;
- óxidos anfóteros;
- óxidos neutros;
- óxidos duplos, salinos ou mistos;
- peróxidos;
- superóxidos ou polióxidos.
Observação: Devemos ter cuidado com a nomenclatura, pois cada um desses grupos ainda reserva uma regra particular.
ÓXIDO BÁSICO
São compostos iônicos sólidos formados por elementos fracamente eletronegativos. São, geralmente, formados por metais com NOX baixo (+1 ou +2).
Exemplos:
Na2O, CaO, K2O, Cu2O
Observação: Têm caráter básico, portanto, quando reagem com água, produzem bases e, quando reagem com um ácido, produzem sal e água.
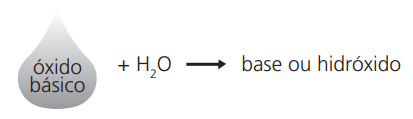
Exemplos: K2O + H2O → 2KOH
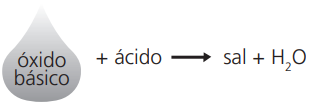
Exemplos: MgO + H2SO4 → MgSO4 + H2O
Exceção: Bi2O3 é um óxido básico, embora seja um óxido de metal com NOX +3.
ÓXIDO ÁCIDO
São compostos moleculares sólidos, líquidos ou gasosos, formados por elementos fortemente eletronegativos. São geralmente formados por metais com NOX elevado (+5, +6 ou +7) ou por ametais.
Exemplos:
SO3, N2O5, C𝓁2O7, Mn2O7, CO2, SiO2, CrO3
Observação: Têm caráter ácido, portanto, quando reagem com água, produzem ácidos e, quando reagem com uma base, produzem sal e água.
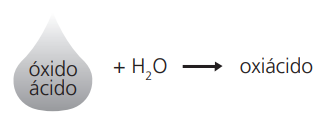
Exemplos:
SO3 + H2O → H2SO4
C𝓁2O7 + H2O → 2HC𝓁O4
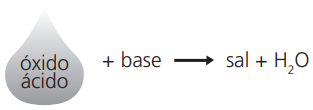
Exemplos:
SO3 + 2NaOH → Na2SO4 + H2O
ÓXIDO ANFÓTERO
São óxidos que apresentam caráter intermediário entre o iônico e o covalente, ou seja, são óxidos com caráter ácido e básico, simultaneamente. São, geralmente, formados por metais com NOX intermediários (+3 ou +4).
Exemplos:
Fe2O3, A2O3, Pb2O3, MnO2
Observação: Como têm caráter ácido e básico simultaneamente, reagem com ácidos ou bases produzindo sal e água.
Óxido anfótero + ácido → sal + água
Exemplo:
A2O3 + 6HCℓ → 3AℓCℓ3 + 3H2O
Óxido anfótero + base → sal + água
Exemplo:
Aℓ2O3 + 2NaOH → 2NaAℓNO2 + H2O
Portanto, um óxido anfótero sempre assume o papel contrário ao do composto com que reage.
Exceções:
- como já dissemos, Bℓ2O3 é um óxido básico.
- ZnO, PbO e SnO apesar de serem óxidos de metal com NOX +2, são óxidos anfóteros.
ÓXIDO NEUTRO (OU INDIFERENTE)
São compostos moleculares gasosos que não reagem com água, ácido ou base e não possuem caráter básico nem ácido: CO, NO, N2O.
Observação:
- NO – monóxido de nitrogênio.
- N2O – monóxido de dinitrogênio, também conhecido como gás hilariante, pois, se inalado, faz com que a pessoa ria de maneira eufórica e estridente.
- CO – monóxido de carbono, que é um gás extremamente tóxico. Isso ocorre porque este composto tem 210 vezes mais afinidade química com a molécula de hemoglobina do que o próprio gás oxigênio. Portanto, a formação de carboxi-hemoglobina é mais favorecida que a formação de oxi-hemoglobina. Com isso, o transporte de oxigênio pelo organismo diminui sensivelmente, podendo levar o indivíduo a sentir sintomas como dor de cabeça, náusea, inconsciência, coma ou até o levar à morte. Há relatos de casos em que pessoas morreram por permanecerem em garagens fechadas com o cano ligado. É importante salientar que este gás é proveniente, principalmente, da queima incompleta de combustíveis como gasolina e diesel e, por isso, que em caso de congestionamento em túneis, os carros devem ter seus motores apagados. Todavia, isto não significa que óxidos neutros não reajam, já que a queima dos três é uma reação bastante comum. Veja um exemplo:

ÓXIDO SALINO, DUPLO OU MISTO
São compostos iônicos sólidos formados a partir de metais com NOX médio igual a +8/3. Em geral: M3O4.
Exemplos:
Fe3O4, Pb3O4, Sn3O4, Mn3O4
Observação: Todos os óxidos salinos têm fórmula molecular X3O4. Óxidos salinos são formados a partir de dois outros óxidos.
Observação:
Quando reagimos estes óxidos com ácidos, devemos ter sempre a formação de dois sais, um com o cátion de carga menor e o outro com o cátion de carga maior.
Observe os exemplos:

PERÓXIDO
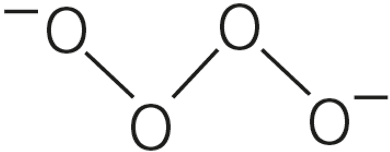
São compostos iônicos sólidos que apresentam o grupo (—O—O—)2-, em que cada oxigênio apresenta NOX –1.
Exceção: H2O2 é a única exceção, pois se trata de um peróxido molecular e líquido.
Observação:
Os peróxidos reagem com água produzindo uma base e oxigênio e reagem com ácidos produzindo sal e peróxido de hidrogênio.

SUPERÓXIDO OU POLIÓXIDO
São compostos binários em que o NOX do oxigênio é igual a –1/2, combinando somente com metais alcalinos e alcalinos-terrosos.
Exemplos:
K2O4, Cs2O4, CaO4, Na2O4
Observação:
- Os superóxidos reagem com água produzindo uma base e oxigênio e reagem com ácidos produzindo sal, peróxido de hidrogênio e oxigênio.

- O radical tem a seguinte fórmula estrutural:
ÓXIDOS ÁCIDOS MISTOS
São óxidos ácidos que, ao reagirem com água, formam dois ácidos diferentes do elemento e, ao reagirem com bases, formam dois sais e água.
Exemplo: N2O4

Observação:
O peróxido de hidrogênio (H2O2) é um composto importantíssimo, pois quando praticamente puro, é um poderoso explosivo e quando dissolvido em H2O, é chamado de água oxigenada. Por ser um composto bastante instável (como os outros peróxidos) se decompõe com tanta facilidade que a simples exposição à luz pode destruí-lo. Por isso, os frascos de água oxigenada são opacos. Também servem para descolorir pelos e cabelos, mas é utilizada principalmente como desinfetante em cortes ou feridas. Quando em contato com o sangue, a enzima catalase decompõe a água oxigenada segundo a reação representada pela seguinte equação:

Observação:
A liberação em alta velocidade do gás oxigênio produz uma espuma branca e dá um aspecto de fervura. Por ser riquíssima em O2, a espuma elimina a ação das bactérias anaeróbicas. Mas o que significa a volumagem (10 V, 20 V, 30 V, 40 V) da água oxigenada? Se uma determinada água oxigenada é decomposta totalmente em água e gás oxigênio, o gás é recolhido e o seu volume é medido nas CNTP. Se o volume for de 10 L, a água oxigenada é chamada de 10 V; se o volume recolhido for de 20 L, a água oxigenada é de 20 V, e assim por diante. A água oxigenada pode ser obtida a partir da reação representada pela seguinte equação:
Na2O2 + H2O → Na2O + H2O2
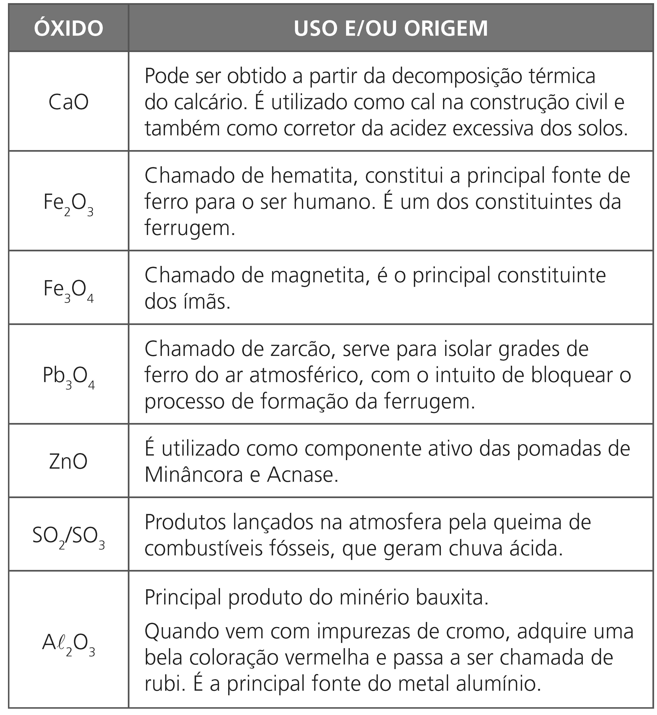
USO COTIDIANO DOS PRINCIPAIS ÓXIDOS
NOMENCLATURA DE ÓXIDOS
PELA CONTAGEM DE ÁTOMOS

Exemplos:
Cu2O – monóxido de cobre
N2O5 – pentóxido de dinitrogênio
Mn2O7 – heptóxido de dimanganês
Fe3O4 – tetróxido de triferro
PARA ELEMENTOS COM NOX FIXO
Óxido de nome do elemento
Exemplos:
Na2O – óxido de sódio
ZnO – óxido de zinco
Al2O3 – óxido de alumínio
BaO – óxido de bário
PARA ELEMENTOS COM 2 NOX POSSÍVEIS
- Pelo NOX absoluto do elemento formador do óxido:
Óxido de nome do elemento NOX
Observação: NOX expresso em algarismo romano.
Exemplos:
Fe2O3 – óxido de ferro III
FeO – óxido de ferro II
Cu2O – óxido de cobre I
CuO – óxido de cobre II
PARA ELEMENTOS COM MAIS DE 2 NOX POSSÍVEIS
Óxido de nome do elemento NOX
Observação: NOX expresso em algarismo romano.
Exemplos:
N2O – óxido de ferro III
NO – óxido de ferro II
N2O3 – óxido de cobre I
NO2 – óxido de cobre II
N2O5 – óxido de nitrogênio V
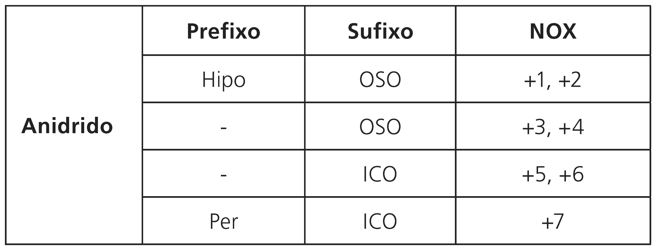
PARA ÓXIDOS ÁCIDOS (ANIDRIDOS)
Exceção:

Exemplos:
Cℓ2O – anidrido hipocloroso
Cℓ2O3 – anidrido cloroso
Cℓ2O5 – anidrido clórico
Cℓ2O7 – anidrido perclórico
PARA ÓXIDOS SALINOS:
Óxido duplo de nome do elemento
Exemplo:
Fe3O4 − óxido duplo de ferro
PARA PERÓXIDOS:
Peróxido de nome do elemento
Exemplos:
Na2O2 – peróxido de sódio
CaO2 – peróxido de cálcio
H2O2 – peróxido de hidrogênio
PARA SUPERÓXIDOS:
Superóxido ou polióxido de nome do elemento
Exemplos:
K2O4 – superóxido de potássio
CaO4 – superóxido de cálcio




