BASES, HIDRÓXIDOS OU ÁLCALIS
Segundo a teoria de Arrhenius, bases são substâncias que, em solução aquosa, se dissociam ionicamente liberando, na forma de ânions, exclusivamente íons OH– e qualquer cátion diferente de H+ (H3O+).

Nota: De modo geral, as bases são formadas por um metal, que constitui o radical positivo, ligado invariavelmente ao OH–. A única base não metálica importante é o hidróxido de amônio (NH4OH).
Observação:
DISSOCIAÇÃO IÔNICA
Os hidróxidos de metais são compostos iônicos constituídos por um metal ligado ao ânion hidróxido (OH–). Portanto, quando em presença de água, sofrem dissociação iônica, constituindo uma solução que apresentará cátion metálico ao lado de ânion hidróxido.
Exemplo:
Dissociação do hidróxido de potássio (KOH) em água:

Dissociação do hidróxido de magnésio [Mg(OH)2] em água:

Através da dissociação iônica das bases, é possível visualizar melhor esta definição. Veja alguns exemplos:

omo as soluções básicas têm íons livres, são soluções eletrolíticas.
BASE A PARTIR DE UMA SUBSTÂNCIA MOLECULAR
Outro exemplo de base é a substância molecular NH3. Ela, em solução aquosa, sofre ionização e origina como único ânion o OH–.

CLASSIFICAÇÃO DE BASES
Costuma-se classificar as bases de acordo com alguns critérios.
NÚMERO DE ÍONS OH– POR FÓRMULA
Conforme o número de íons OH– existentes na fórmula das bases, temos:
Monobase: contém um OH– na fórmula.
Exemplo: NaOH, KOH, NH4OH, CuOH
Dibase: contém dois OH- na fórmula.
Exemplo: NaOH, KOH, NH4OH, CuOH
Tribase: contém três OH- na fórmula.
Exemplo: Al(OH)3, Bi(OH)3, Ni(OH)3, Fe(OH)3
Tetrabase: contém quatro OH- na fórmula.
Exemplo: Pb(OH)4, Sn(OH)4
VOLATILIDADE
Analisando os pontos de ebulição das bases, pode-se classificá-las em:
Fixas: apresentam elevado ponto de ebulição (todas as bases de metais).
Exemplo: NaOH, KOH, Ca(OH)2
Voláteis: apresentam baixo ponto de ebulição.
Exemplo: NH4OH
SOLUBILIDADE
Entende-se por solubilidade a propriedade que apresenta as substâncias de se disseminarem em outras. Desse modo, as bases classificam-se em:
Muito solúveis: bases de metais alcalinos e amônio.
Exemplo: NaOH, KOH, NH4OH, LiOH, CsOH
Nota: O hidróxido de amônio (NH4OH), como visto anteriormente, só existe em solução aquosa. É, portanto, uma base solúvel em água.
Pouco solúveis: bases de metais alcalinos-terrosos.
Exemplo: Ca(OH)2, Ba(OH)2, Be(OH)2
Praticamente insolúveis: demais bases.
Exemplo: Al(OH)3, Bi(OH)3, Ni(OH)3, Fe(OH)3
FORÇA
Conforme o grau de dissociação iônica (α), as bases podem ser classificadas em:
Fortes (α > 50%): bases de metais alcalinos e alcalinos-terrosos (grau de dissociação iônica elevado próximo de 100%).
Exemplo: NaOH, KOH, Ca(OH)2, Sr(OH)2
Fracas (α > 50%): grau de dissociação iônica baixo e próximo de 0%.
Exemplo: NH4OH, AgOH, Fe(OH)3, Ni(OH)3
Observação:
- O Mg(OH)2 é praticamente insolúvel em água e é uma base fraca.
- O NH4OH é a única base fraca que é solúvel em água.
Além disso, é a única base molecular e, portanto, ioniza-se e não dissocia-se através da equação:

NOMENCLATURA DE BASES
PARA ELEMENTOS COM NOX FIXO
Hidróxido de nome do elemento.
Exemplo:
NaOH – hidróxido de sódio.
Zn(OH)2 – hidróxido de zinco.
Aℓ(OH)3 – hidróxido de alumínio.
Ba(OH)2 – hidróxido de bário.
PARA ELEMENTOS COM 2 NOX POSSÍVEIS
PELO NOX ABSOLUTO DO ELEMENTO FORMADOR DO HIDRÓXIDO
Hidróxido de nome do elemento + NOX
Observação: NOX expresso em algarismo romano.
Exemplo:
Fe(OH)3 – hidróxido de ferro III.
Fe(OH)2 – hidróxido de ferro II.
CuOH – hidróxido de cobre I.
Cu(OH)2 – hidróxido de cobre II.
PELO NOX RELATIVO

Exemplo:
Fe(OH)3 – hidróxido férrico.
Fe(OH)2 – hidróxido ferroso.
CuOH – hidróxido cuproso.
Cu(OH)2 – hidróxido cúprico.
FORMULAÇÃO DAS BASES
Regra geral de formulação das bases:
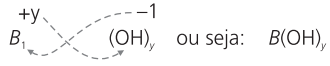
Exemplo:

PROPRIEDADES FUNCIONAIS DE ÁCIDOS E BASES
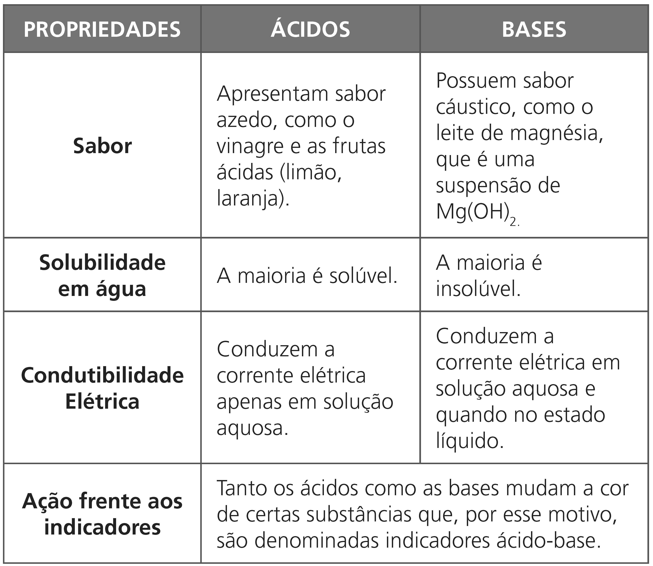
INDICADORES ÁCIDO-BASE (INDICADORES DE COR)
Substâncias que adquirem coloração distinta frente a um ácido ou uma base são chamadas de indicadores ácido-base.
Existe um grande número de indicadores ácido-base, uns mais preciosos (costumam ser os indicadores laboratoriais) e outros nem tanto.
Os indicadores mais utilizados em laboratório são:
- papel de tornassol (azul e vermelho);
- fenolftaleína;
- alaranjado de metila (metil orange);
- azul de bromotimol.
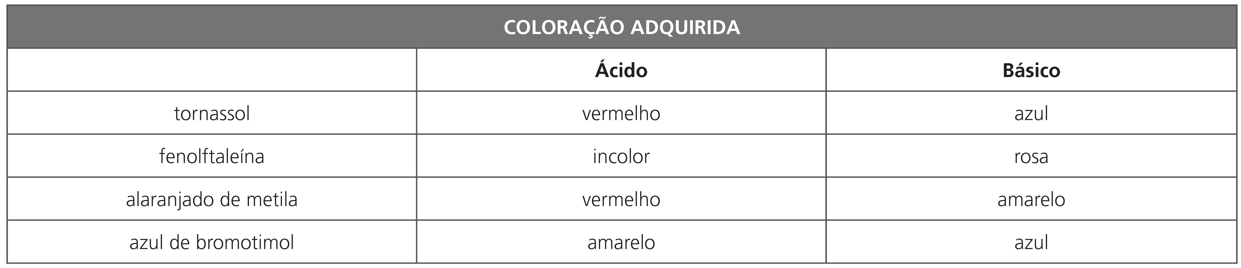
COMPLEMENTO: FUNCIONALIDADE E APLICAÇÃO DE ALGUMAS BASES