LIGAÇÕES (OU FORÇAS) INTERMOLECULARES
INTERAÇÃO DIPOLO – DIPOLO (OU DIPOLO PERMANENTE)
Ocorre entre moléculas polares. Podem ser classificadas em fortes, Ligação de Hidrogênio e fracas, Interação Dipolo–Dipolo.
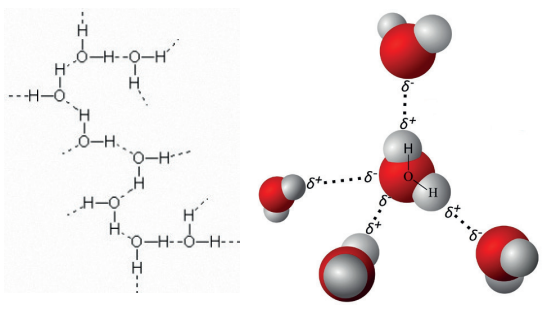
LIGAÇÃO DE HIDROGÊNIO
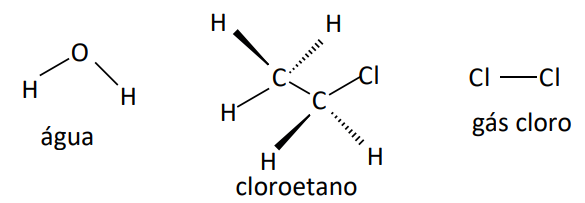
Ocorre em moléculas polares que apresentam, em sua estrutura, o átomo de hidrogênio ligado aos átomos de flúor, oxigênio ou nitrogênio.
Exemplo:
Ligações de hidrogênio entre as moléculas de água.
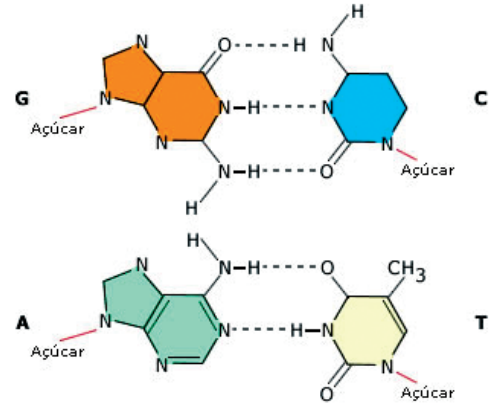
Ligações de hidrogênio no DNA.
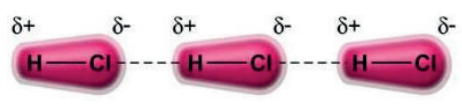
INTERAÇÃO DIPOLO–DIPOLO
Ocorre nas demais moléculas polares.
Exemplo:
Interação Dipolo–Dipolo entre as moléculas do cloreto de hidrogênio (HC𝓁):
INTERAÇÃO DIPOLO INDUZIDO
Ocorre entre moléculas apolares. São muito fracas quando comparadas às anteriores; esse tipo de ligação ocorre devido a uma indução elétrica promovida no momento do contato entre duas moléculas.
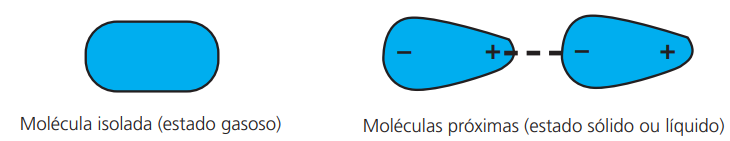
Observação: Quando ocorre em substâncias no estado gasoso, a Interação Dipolo Induzido é denominada de Forças de Van der Waals. Nos estados líquido e sólido, essa interação recebe o nome de Forças de London.
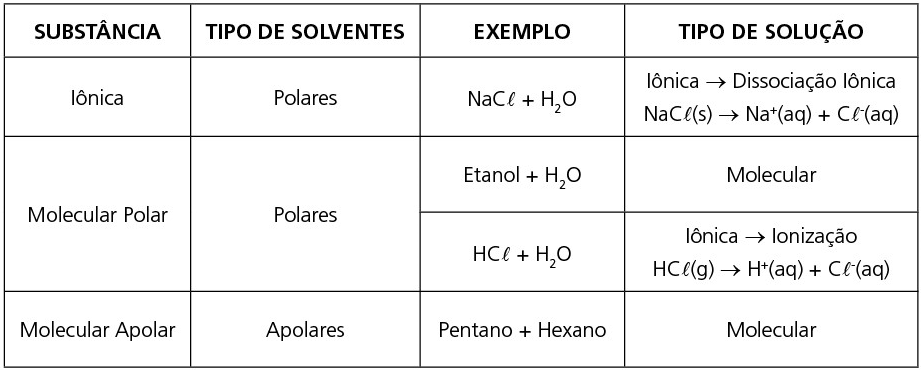
CLASSIFICAÇÃO DAS SUBSTÂNCIAS EM RELAÇÃO ÀS SUAS LIGAÇÕES QUÍMICAS
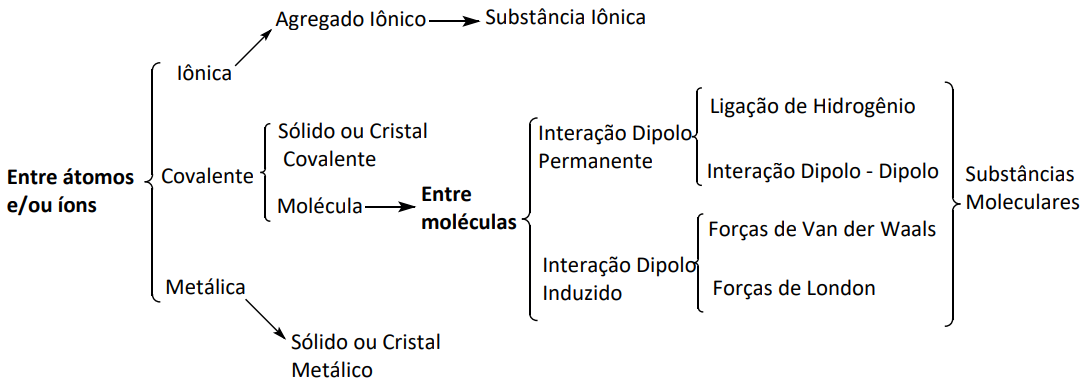
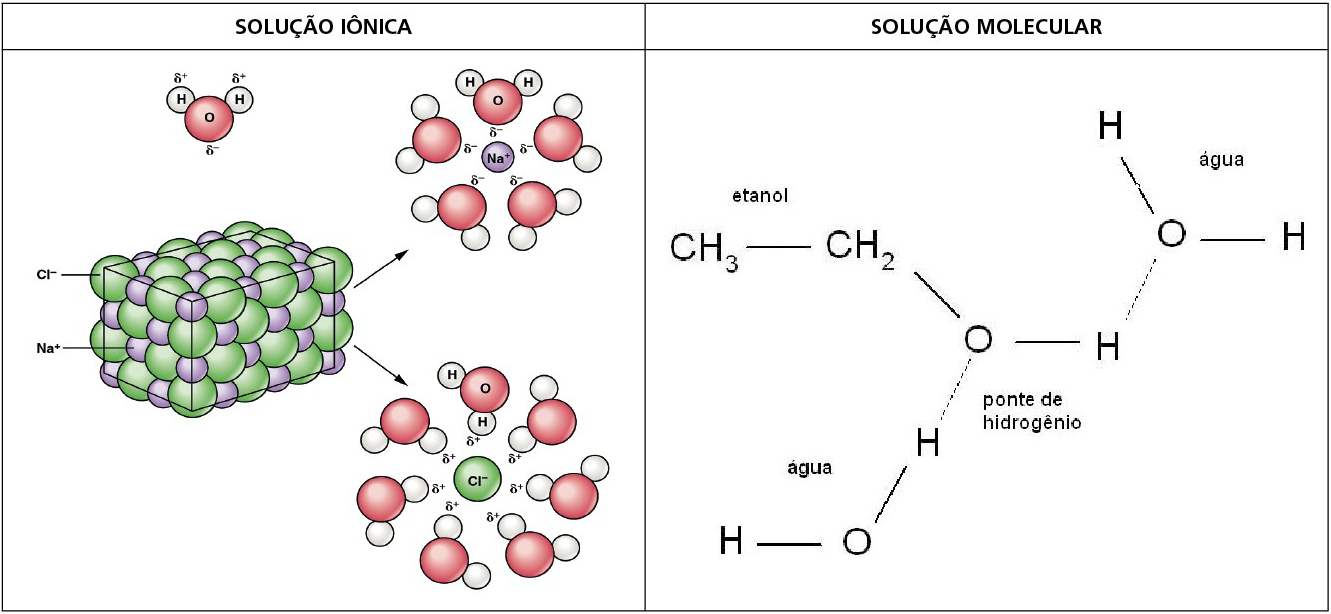
SUBSTÂNCIAS IÔNICAS
Formadas por agregados iônicos, são estruturas sólidas cristalinas, no cátion ou no ânion podemos ter a ligação covalente. Apresentam elevados valores para sua temperatura de fusão, não são condutoras de eletricidade no estado sólido, porém podem conduzir, por vezes demasiadamente, quando são líquidas ou se estiverem solubilizadas em solventes polares como a água.
Exemplos:
Os sais, como o cloreto de sódio (NaC𝓁) e as bases, como o hidróxido de sódio (NaOH).
SUBSTÂNCIAS COVALENTES
Formadas exclusivamente por ligações covalentes, são estruturas cristalinas sólidas de elevadíssimas temperaturas de fusão. Não conduzem a eletricidade, e são insolúveis na grande maioria de solventes.
Exemplos:
O melhor exemplo a se considerar é o diamante.
SUBSTÂNCIAS METÁLICAS
Formadas exclusivamente por ligações metálicas, são estruturas cristalinas sólidas de elevadas temperaturas de fusão. São excelentes condutores de eletricidade no estado sólido, só se solubilizam em determinadas substâncias quando sofrem ataque químico corrosivo.
Exemplo:
Os metais e ligas metálicas em geral.
Observação: O mercúrio é um metal que se encontra no estado líquido nas condições ambientes. Esse fato ocorre porque o mesmo apresenta estruturas diméricas interligadas por ligações muito fracas (Forças de Van der Waals).
SUSTÂNCIAS MOLECULARES
Suas moléculas apresentam ligações covalentes entre seus átomos. Entre suas moléculas, apresentam ligações que dependem da polaridade da mesma e, consequentemente, da intensidade dessas interações. Pelo mesmo motivo, podem ser encontradas nos três estados físicos. Os valores de suas temperaturas de fusão e ebulição podem variar, porém são inferiores aos das substâncias anteriores.
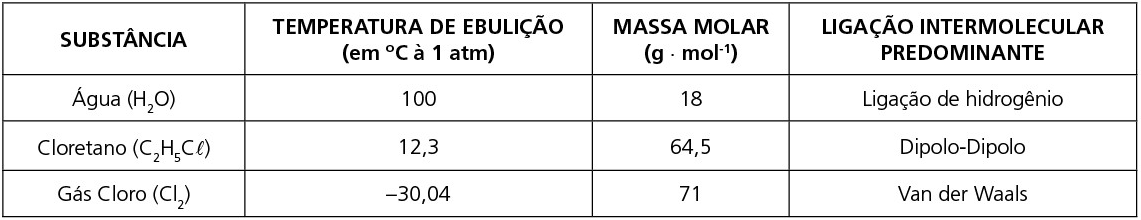
PRINCIPAIS CASOS DE COMPARAÇÃO ENTRE AS TEMPERATURAS DE FUSÃO E EBULIÇÃO EM SUBSTÂNCIAS MOLECULARES E SUAS LIGAÇÕES INTERMOLECULARES
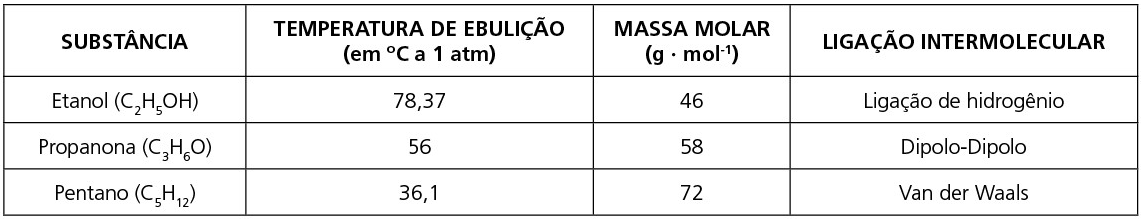
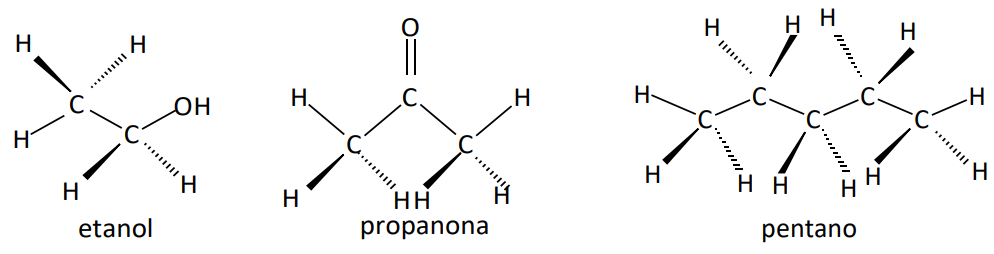
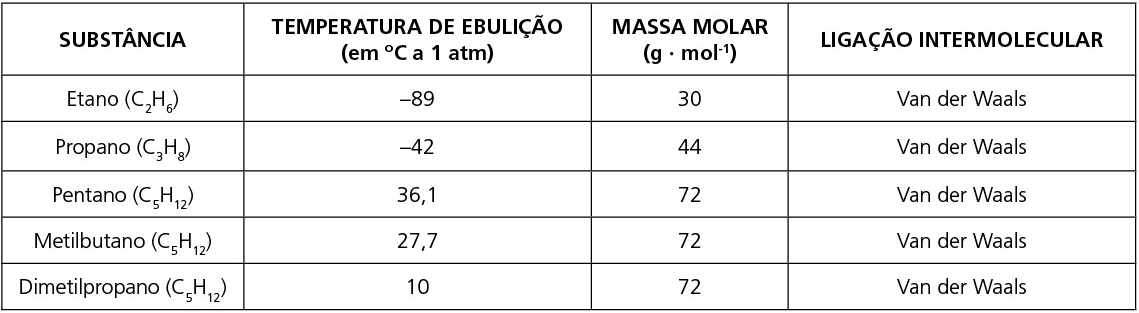
a) Quando são diferentes as forças intermoleculares, na maioria dos casos, terá maior temperatura de fusão e ebulição aquela que apresentar a força intermolecular de maior intensidade.
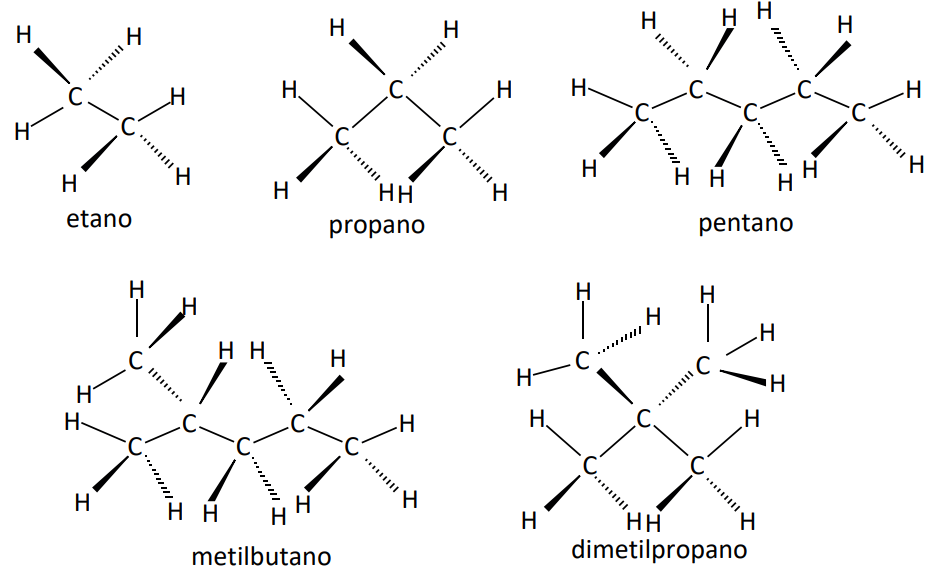
b) Quando são moléculas apolares, geralmente a maior temperatura de fusão e ebulição será daquela que apresentar a maior massa molar. Quando apresentarem a mesma massa molar, terá a maior temperatura de fusão e ebulição aquela que oferece maior superfície de contato entre suas moléculas.
Observe as tabelas:
PRINCIPAIS CASOS DE SOLUBILIDADE EM SUBSTÂNCIAS IÔNICAS E MOLECULARES