Observação: um metal, quando suficientemente aquecido, emite luz que pode ser decomposta por meio de um prisma.
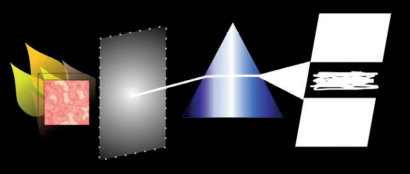
Esse modelo foi bem recebido, pois explicava satisfatoriamente o espectro do átomo de hidrogênio.
Segundo Bohr, o elétron do átomo de hidrogênio poderia apresentar vários tipos de saltos de retorno ou transições. A cada tipo de salto corresponderia uma emissão de energia através de uma onda eletromagnética.
Os cientistas já sabiam que cada elemento químico possui um espectro característico. O alemão Bunsen usou esse fato na descoberta do rubídio (1861) e do césio (1860).
O modelo atômico de Bohr explicava o espectro do hidrogênio, mas não servia para esclarecer os espectros de átomos com vários elétrons. Isso foi resolvido por teorias mais complexas, desenvolvidas principalmente por Heisenberg, Dirac, De Broglie e Schrödinger.
DUALIDADE PARTÍCULA-ONDA
Em síntese, o elétron apresenta um comportamento duplo, de partícula e de onda; portanto, diz-se que a natureza do elétron é a de uma partícula-onda.
Elétron → partícula-onda
PRINCÍPIO DA INCERTEZA DE HEISENBERG
Esse princípio diz que é impossível conhecer, ao mesmo tempo, a posição e a velocidade de uma partícula como o elétron.
Como explicar esse princípio?
Vamos imaginar que tenhamos um “supermicroscópio” que permitisse visualizar o elétron. Para “ver” o elétron seria necessária uma forma de radiação (raios-X, luz ultravioleta etc.). Partículas muito pequenas como elétrons, e até mesmo átomos, se comportam diferentemente de partículas grandes do nosso dia a dia. Os elétrons, por exemplo, podem receber qualquer tipo de radiação eletromagnética aumentando sua energia cinética e, portanto, sua velocidade. Devido a isto, quando a radiação que foi usada para enxergá-la atingisse-o, ele iria adquirir mais velocidade e mudaria rapidamente de posição, ou seja, torna-se impossível determinar a posição exata do elétron no átomo.
“Quando qualquer tipo de radiação eletromagnética atinge partículas subatômicas, estas conseguem absorvê-la, transformando em energia cinética, o que altera rapidamente a velocidade das mesmas. “
DIAGRAMA DE PAULING
Sabe-se já que a eletrosfera do átomo pode ser dividida em níveis (correpondente ao número quântico principal), e, cada nível, pode ainda ser dividido em subníveis de energia (número quântico secundário). Vem a seguinte pergunta:
Como os elétrons de um átomo estão distribuídos?
Será que eles ocupam aleatoriamente esses níveis e subníveis?
Os elétrons não ocupam de maneira desordenada os níveis e subníveis de um átomo. Os elétrons são sempre distribuídos em ordem crescente de energia desses níveis e subníveis.
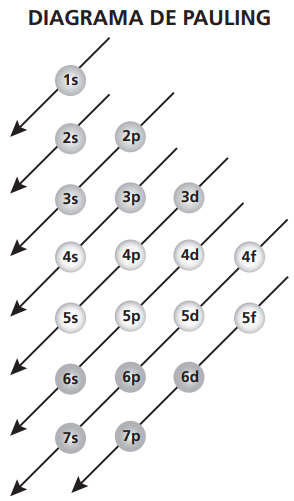
Linus Pauling estudou e elaborou um diagrama que descreve como fazer a distribuição dos elétrons em um átomo qualquer, de modo que, seguindo o diagrama, estaremos seguindo exatamente a ordem crescente de energia dos subníveis.
Para fazer esse diagrama, Pauling considerou que a energia do elétron (E) é dada pela soma dos valores do número quântico principal (n) com a do número quântico secundário (ℓ), ou seja: E = n+ℓ.
É com esse diagrama que se faz a configuração ou distribuição eletrônica dos átomos, sempre seguindo do subnível menos energético para o mais energético.
A configuração eletrônica sempre segue as setas do diagrama de Pauling mostrado a seguir:
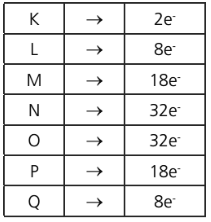
Cada nível comporta um número máximo de elétrons:
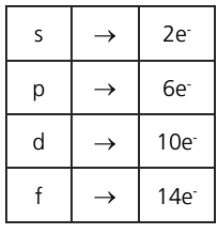
Cada subnível comporta um número máximo de elétrons:
Exemplo: Mg (Z – 12) No estado fundamental, ou seja, sem carga elétrica, tem-se 12 e-. Vamos agora seguir as setas do diagrama de Pauling, sempre preenchendo cada subnível com o máximo de elétrons que ele suporta:
12Mg → 1 s22s22p63s2
CAMADA DE VALÊNCIA X SUBNÍVEL MAIS ENERGÉTICO
CAMADA DE VALÊNCIA – corresponde ao maior valor de (número quântico principal) da distribuição.
Os elétrons que estão nesta camada de valência, que corresponde à última camada do átomo, são chamados de elétrons de valência.
Exemplo:
Mg (Z = 2)→1 s22s22p63s2
Neste caso, o maior valor de n é 3 , ou seja, sua camada de valência é a 3.
SUBNÍVEL MAIS ENERGÉTICO – corresponde ao último subnível da distribuição eletrônica e nele estão os elétrons mais energéticos do átomo.
Exemplo:
Façamos a distribuição do escândio (21Sc):
Sc (Z = 21): 1s22s22p63s23p64s23d1
Neste caso, apesar do nível de valência ser o 4 (maior valor de n), o subnível mais energético é o 3d (último da distribuição).
DISTRIBUIÇÃO ELETRÔNICA DE ÍONS
Para fazer a distribuição eletrônica de um íon devemos lembrar que:
Íons são resultado da perda ou ganho de elétrons pelo átomo.
PERDA: cátions (+) | GANHO: ânions (-)
CÁTION: deve-se seguir dois passos para fazer a distribuição eletrônica de cátions:
1 – Fazer a distribuição do átomo neutro correspondente.
2 – Retirar os elétrons necessários sempre da camada de valência.
Exemplo: 11Na+
1 – Na (Z = 11): 1 s22s22p63s1
2 – Retira-se agora 1 e- para tornar-se Na+, da camada de valência (n = 3).
Na+ → 1 s22s22p6
ÂNIONS: segue os mesmos passos do cátion, sendo que ao invés de retirar elétrons da camada de valência, se adiciona.
Exemplo: 16S2-
Lembrando-se neste caso, que para formar um ânion bivalente, foi preciso ganhar dois elétrons. Para se fazer a distribuição, primeiro sempre se faz a do átomo correspondente, ou seja, S (Z = 16):
16S→1 s22 s22p63 s23p4
Agora, basta colocar 2e- na camada de valência (n = 3). Como o subnível 3s está cheio (número máximo de elétrons no s é 2), coloca-se no 3p, ficando assim:
16S2- → 1 s22 s22p63s23p6
DISTRIBUIÇÃO ELETRÔNICA EM ORBITAIS
Os elétrons podem ser distribuídos também nos orbitais. Para isto, seguimos duas regras:
Princípio da exclusão de Pauli: num orbital existem, no máximo, dois elétrons com spins opostos.
Regra de Hund: deve-se preencher os orbitais de cada subnível de modo que tenhamos o maior número possível de elétrons desemparelhados.
Exemplo: façamos a distribuição do 7N.
N(Z = 7):
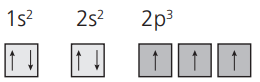
Observe o subnível 2 p acima. Veja que existem 3 elétrons desemparelhados, que é a configuração mais adequada para a regra de Hund.
Seria INCORRETO assim:
N(Z = 7):
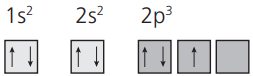
Para cada subnível deve-se preencher todos os orbitais. Primeiro, os elétrons com um só spin; depois que completar todos os orbitais, deve-se voltar para o primeiro orbital e continuar o preenchimento com o outro spin.
REGRAS PARA DISTRIBUIÇÃO ELETRÔNICA
Quando todos os elétrons de um átomo estiverem nas posições de menor energia permitida, teremos uma configuração eletrônica normal ou fundamental.
Para conseguir a configuração eletrônica fundamental de um átomo, observe as seguintes regras:
1) descubra, através do número atômico, quantos elétrons o átomo possui;
2) distribua os elétrons segundo a ordem crescente de energia dos subníveis;
3) preencha um subnível somente depois que os anteriores estiverem completos;
4) obedeça sempre às regras de Pauli e Hund.
Esse caminho, chamado por alguns cientistas de Método de Aufbau, mostra o estado fundamental de um átomo isolado. Nessas condições, o átomo teria a menor energia permitida e, portanto, a maior estabilidade possível no estado isolado, isto é, sem estar ligado a um outro átomo.
Veja as distribuições eletrônicas fundamentais de alguns átomos:
1H – 1 s1: um elétron no subnível s do 1º nível.
2He – 1 s2: dois elétrons no subnível s do 1º nível.
3Li – 1 s22 s1: dois elétrons no subnível s do 1º nível e um elétron no subnível s do 2º nível.
Exemplo:

Em átomos maiores, podemos reagrupar os subníveis para efetuar a contagem de elétrons em cada nível.
DISTRIBUIÇÕES ELETRÔNICAS MAIS ESTÁVEIS
Vários átomos não seguem rigorosamente as regras de distribuição eletrônica. Dentre os mais importantes, podemos destacar o cromo e o cobre.

Isso parece dever-se ao fato de que subníveis completos ou semipreenchidos conferem maior estabilidade ao átomo.
QUI_1004 (PROENEM):
- NÚMEROS QUÂNTICOS
- CONCEITOS FUNDAMENTAIS
- DIAMAGNETISMO E PARAMAGNETISMO
NÚMEROS QUÂNTICOS
São números que servem para localizar o elétron. São eles:
Número quântico principal (n): localiza o elétron no seu nível de energia.
Número quântico secundário ou Azimutal (l): localiza o elétron no seu subnível de energia.
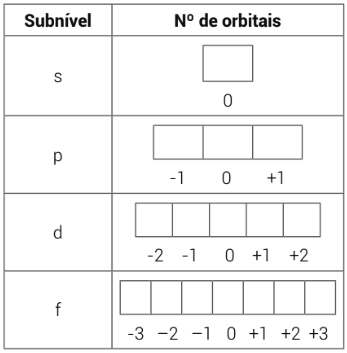
Número quântico magnético (m): localiza o elétron no seu orbital. Orbital é a região do espaço onde existe a maior probabilidade de se encontrar um elétron. Para representar o orbital, iremos utilizar a “caixa”, onde cada caixa representará um orbital:

Cada orbital comporta no máximo dois elétrons, e cada um dos subníveis possui uma determinada quantidade de orbitais. Veja na tabela abaixo:
Número quântico de spin (ms) : indica o sentido de rotação do elétron.
Por convenção, representa-se o elétron por uma seta (↑). O valor do spin deve ser informado. Neste material, o primeiro elétron a ser alocado no orbital terá a seta voltada para cima e terá valor de spin negativo.
↑ = ms = -1/2
↓ = ms = +1/2
CONCEITOS FUNDAMENTAIS
Para alocar os elétrons nos orbitais, deve-se levar em consideração algumas informações. São eles:
- Princípio da Exclusão de Pauli: é impossível dois elétrons de um mesmo átomo possuírem os quatro valores de números quânticos iguais.
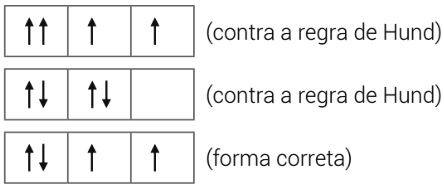
- Regra de Hund: o pareamento de elétrons só pode ocorrer após todos os orbitais estarem semipreenchidos.
Exemplo: p4
- Elétron diferenciador: é o último elétron localizado no subnível mais energético.
Exemplo: 3Li → 1 s22s1
- Elétron de valência: é o último elétron localizado na camada de valência (camada mais externa).
Exemplo: 26Fe→1 s22s22p63s23p64s23d6
DIAMAGNETISMO E PARAMAGNETISMO
Alguns elementos podem sofrer ação de um campo magnético externo. São definidos como:
- Paramagético: é o átomo que possui pelo menos um elétron desemparelhado dentro do orbital.
Exemplo: 26Fe→1 s22s22p63s23p64s23d5
Observe que no átomo de ferro temos 4 elétrons desemparelhados e 2 elétrons emparelhados, logo, o átomo de ferro é paramagnético.
- Diamagnético: é o átomo que possui apenas elétrons emparelhados dentro do orbital.




