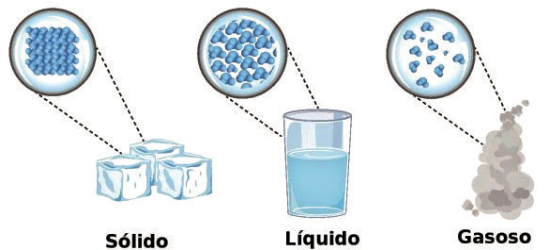
ESTADOS FÍSICOS DA MATÉRIA OU FASES DA MATÉRIA
Em geral, conforme a variação de energia cinética e potencial das partículas (moléculas ou íons) que constituem a substância, ela poderá se apresentar na fase sólida, líquida ou gasosa.
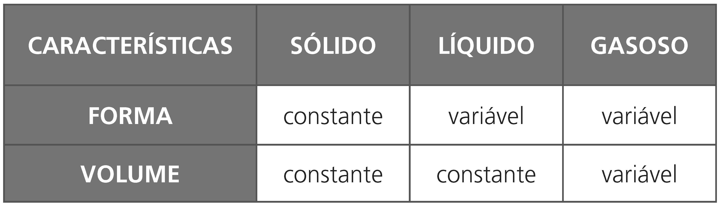
Esses três estados — sólido, líquido e gasoso — são chamados de estados físicos ou estados de agregação da matéria, e as transformações de um estado para outro são denominadas mudanças de estado físico da matéria.
Fonte: http://quimicado8ano.blogspot.com
MUDANÇA DE ESTADOS FÍSICOS
Fonte: http://polemicascmm.blogspot.com
Observação:
- A rigor, o termo estado da matéria (substância ou mistura) é reservado pela termodinâmica para se referir a uma temperatura, pressão e volume específicos que a matéria apresenta em um dado momento. Uma porção de matéria numa determinada fase de agregação pode se apresentar em diversos estados diferentes. Por exemplo, na fase gasosa a substância água pode se apresentar no estado 1 (110 °C, 1 atm, 500 mL) ou no estado 2 (75 °C, 0,9 atm, 500 mL).
- Uma substância que se encontre numa determinada fase de agregação pode mudar de fase caso receba ou perca energia (calor).
- As mudanças de fase caracterizam-se pela formação ou quebra de ligações intermoleculares, logo, envolve calor latente. Já os aquecimentos e resfriamentos, calor sensível.
- Temperatura (ou ponto) de fusão (P.F.) x Temperatura (ou ponto) de ebulição (P.E.).
P.F. – é uma temperatura característica na qual determinada substância sofre fusão.
ponto ou temperatura de fusão = ponto ou temperatura de solidificação
P.E. – é uma temperatura característica na qual determinada substância sofre ebulição.
ponto ou temperatura de ebulição = ponto ou temperatura de condensação
*O ponto de ebulição depende diretamente da pressão atmosférica e esta varia com a altitude.
Quanto maior a pressão sobre o sistema, maior será o ponto de ebulição da substância e vice-versa.
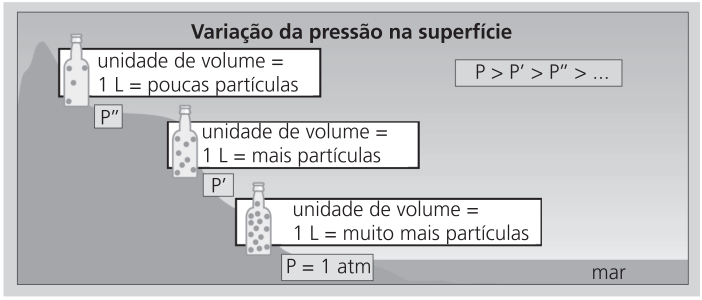
A Terra está envolvida por uma camada de ar que tem espessura aproximada de 800 km. Essa camada de ar exerce pressão sobre os corpos: pressão atmosférica.
A pressão atmosférica varia de acordo com a altitude. Em regiões de grande altitude, há menor quantidade de partículas do ar por unidade de volume, portanto a pressão também é menor.
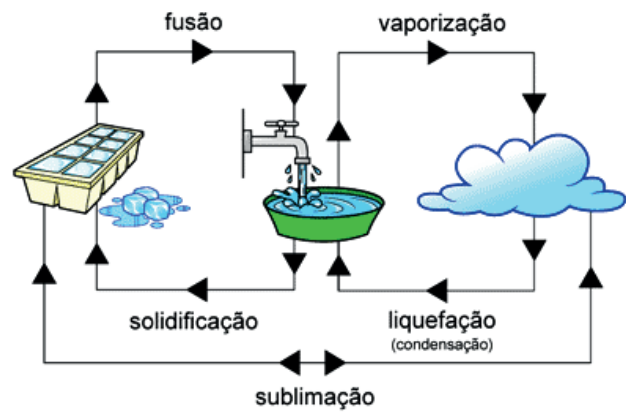
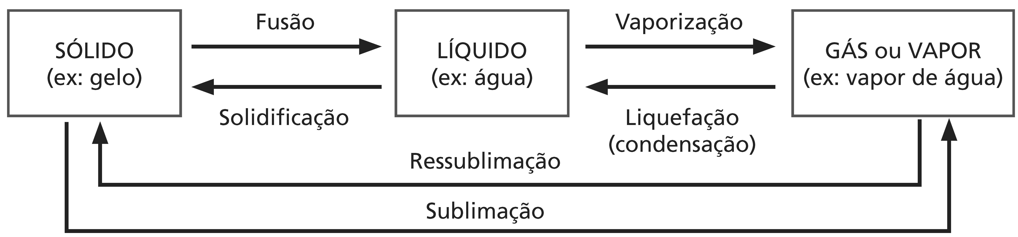
MUDANÇAS DE FASE
Observação
- A vaporização pode ocorrer de 3 formas:
Evaporação é a vaporização lenta, que ocorre na superfície do líquido, sem agitação nem surgimento de bolhas. Ebulição é a vaporização rápida, com agitação do líquido e aparecimento de bolhas. Calefação é uma vaporização muito rápida, com gotas do líquido “pulando” em contato com uma superfície ultra-aquecida.
- evaporação – quando ocorre em temperatura < ponto de ebulição
- ebulição – quando ocorre em temperatura ≥ ponto de ebulição
- calefação – quando ocorre com grande diferença de temperatura entre as partes
- A sublimação, em geral, ocorre pois as ligações intermoleculares são muito fracas.
Exemplo: iodo (I2), gelo seco (CO2), naftalina (C10H8)
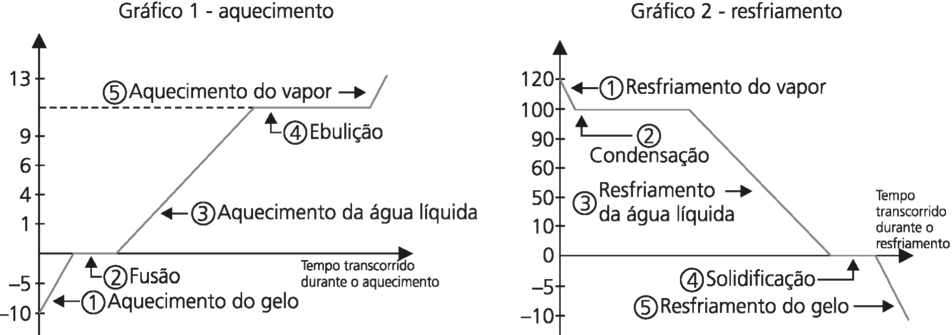
- Comparação gráfica entre aquecimento e resfriamento de substâncias: