EQUILÍBRIO IÔNICO EM BASES SOLÚVEIS
As bases também produzem íons quando dissolvidas ou formadas em água, gerando mais um tipo de equilíbrio semelhante ao ocorrido nos ácidos, porém com enfoque na geração de OH–(aq). Vale frisar que o equilíbrio será estudado para as bases solúveis em água.
Equações usuais para este equilíbrio:

ONSTANTE DE EQUILÍBRIO (KB), GRAU DE IONIZAÇÃO (Α) E LEI DA DILUIÇÃO DE OSTWALD
Segue-se os mesmos padrões utilizados para os ácidos:

Para as bases fracas (α < 5%), pode-se utilizar as seguintes expressões: Kb = m · α2 e [B+] = [OH–] = m · α.
ADIÇÃO DE MONOBASES FORTES EM ÁGUA
Neste caso, tem-se que α = 100%. Vale frisar que, como [OH-] > [H+], tem-se um meio aquoso básico. Considere as seguintes equações:

A [OH–] = [Na+], logo, a adição de Na+ não altera o equilíbrio ficando livre na solução. O deslocamento da reação se dará para a esquerda com a diminuição da [H+] (abaixo de 10-7 mol/L e o Kw permanecerá constante).
Observação: caso sejam misturadas soluções ácidas (α = 100%) com soluções básicas (α = 100%), a solução resultante será neutra quando o número de mols de H+ for igual ao número de mols de OH–. Caso contrário, após a neutralização parcial, o íon que sobrar irá dar o caráter ácido ou básico à solução resultante da mistura.
DESLOCAMENTO NOS EQUILÍBRIOS ÁCIDO-BASE
Um equilíbrio inicial de ácido ou base poderá ser perturbado por adição de sensíveis quantidades de ácidos, bases ou sais, os quais gerarão íons comuns ou não comuns à situação inicial de equilíbrio.
EFEITO DO ÍON COMUM
Situação inicial de equilíbrio: HA(aq) ⇌ H+(aq) + A–(aq)
I- Adição de gotas de limão no equilíbrio acima (irá aumentar a quantidade de H+)
II- Adição do sal NaA no equilíbrio acima (irá aumentar a quantidade de A–)
Conclusões após as adições:
– O equilíbrio inicial será deslocado para esquerda;
– O grau de ionização do ácido (HA) irá diminuir;
– Kw e Ka não variarão.
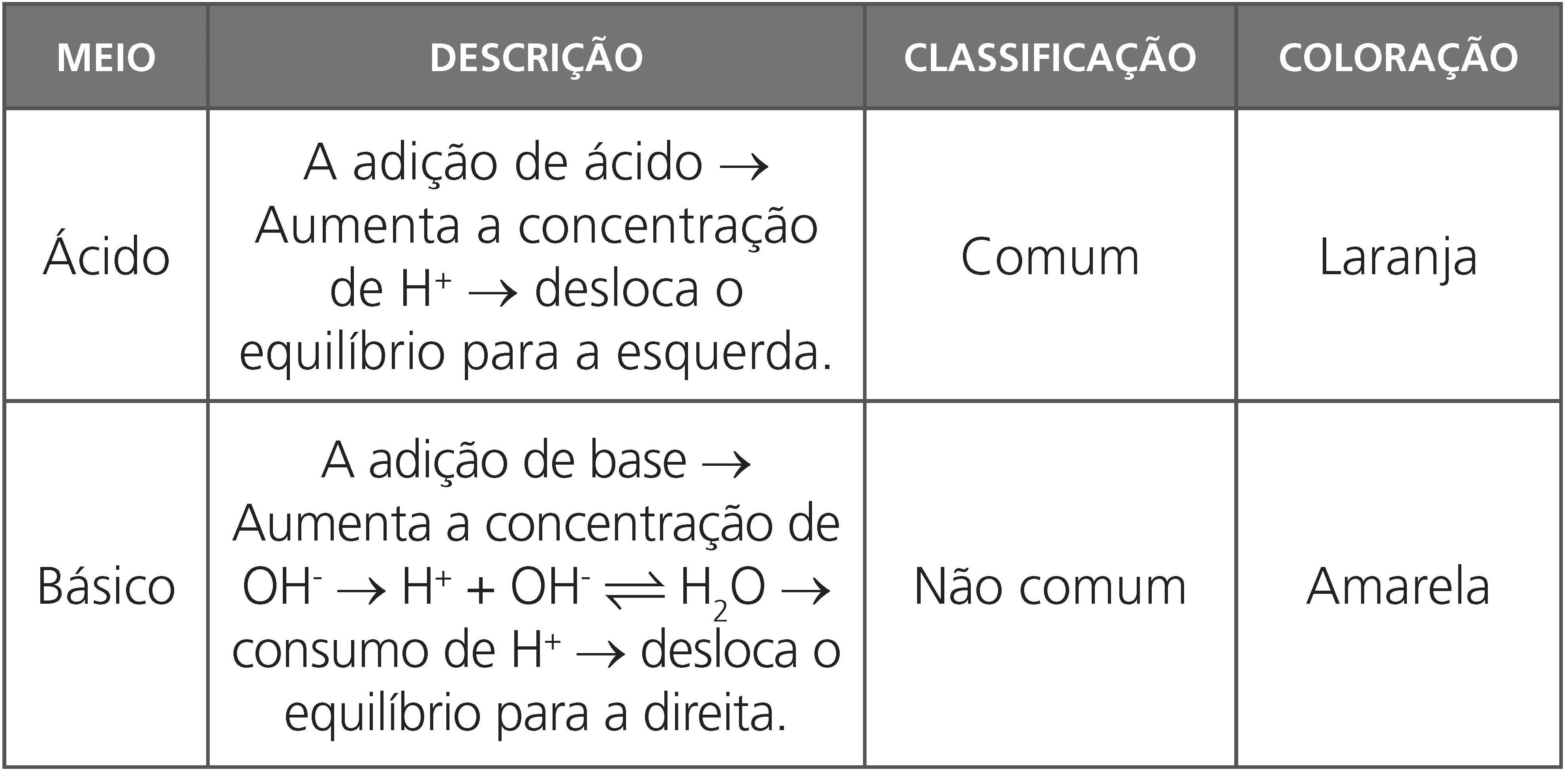
EFEITO DO ÍON NÃO COMUM
Situação inicial de equilíbrio: HA(aq) ⇌ H+(aq) + A–(aq)
I- Adição de gotas de solução alcalina (o OH– da base irá capturar o H+ do equilíbrio inicial do ácido)
II- Adição de um cátion que capture o ânion A– do equilíbrio inicial do ácido.
Conclusões após as adições:
– O equilíbrio inicial será deslocado para direita;
– O grau de ionização do ácido (HA) irá aumentar;
– Kw e Ka não variarão.
Para um equilíbrio inicial básico, as conclusões serão as mesmas acima, para efeitos semelhantes.
Exemplo: